Komplet redoxreaktion under sur tilstand MnO4 H2O2?
1. Identificer halvreaktionerne
* Oxidation: H₂O₂ → O₂
* reduktion: Mno₄⁻ → Mn²⁺
2. Balanceatomer (undtagen O og H)
* Begge halvreaktioner er allerede afbalanceret med hensyn til MN og O.
3. Balance iltatomer
* Oxidation: H₂O₂ → O₂ + 2H₂O
* reduktion: Mno₄⁻ → mn²⁺ + 4h₂o
4. Balance hydrogenatomer
* Oxidation: H₂O₂ → O₂ + 2H₂O
* reduktion: Mno₄⁻ + 8H⁺ → Mn²⁺ + 4H₂O
5. Balanceafgift
* Oxidation: H₂O₂ → O₂ + 2H⁺ + 2E⁻
* reduktion: Mno₄⁻ + 8H⁺ + 5E⁻ → Mn²⁺ + 4H₂O
6. Udligning af elektronoverførsel
* Multiplicer oxidationen halvreaktion med 5 og reduktionen halvreaktion med 2:
* 5H₂O₂ → 5O₂ + 10H⁺ + 10E⁻
* 2MNO₄⁻ + 16H⁺ + 10E⁻ → 2MN²⁺ + 8H₂O
7. Kombiner halvreaktionerne
2mno₄⁻ + 5H₂O₂ + 6H⁺ → 2mn²⁺ + 5o₂ + 8H₂O
endelig afbalanceret redoxreaktion:
2mno₄⁻ (aq) + 5h₂o₂ (aq) + 6H⁺ (aq) → 2mn²⁺ (aq) + 5o₂ (g) + 8H₂O (l)
Sidste artikelHvad er pH af regnvand i ligevægt med atmosfære?
Næste artikelHvilken slags komponenter er der i zink?
 Varme artikler
Varme artikler
-
 Undersøgelse kaster nyt lys over produktionen af hydroxylradikaler, som hjælper med at nedbryde …Et forskerhold, der omfattede Argonne-kemikeren Stephen Klippenstein, undersøgte produktionen af hydroxylradikaler, som hjælper med at nedbryde luftforurenende stoffer, i et nyt lys. Kredit:LALS STO
Undersøgelse kaster nyt lys over produktionen af hydroxylradikaler, som hjælper med at nedbryde …Et forskerhold, der omfattede Argonne-kemikeren Stephen Klippenstein, undersøgte produktionen af hydroxylradikaler, som hjælper med at nedbryde luftforurenende stoffer, i et nyt lys. Kredit:LALS STO -
 Nyligt forbedret glasglas gør mikroskoper til termometreEt foto af eksperimentet med et objektglas med den nye belægning. Kredit:University at Buffalo Det ydmyge mikroskopobjektglas i glas kan primes til en makeover. En undersøgelse offentliggjort onl
Nyligt forbedret glasglas gør mikroskoper til termometreEt foto af eksperimentet med et objektglas med den nye belægning. Kredit:University at Buffalo Det ydmyge mikroskopobjektglas i glas kan primes til en makeover. En undersøgelse offentliggjort onl -
 SLACs højhastighedselektronkamera filmer molekylær film i HDForskere skabte den første film med atomopløsning af ringåbningsreaktionen af 1, 3-cyclohexadien (CHD) med et elektronkamera kaldet UED. Nederst:UED-elektronstrålen måler nøjagtigt afstandene mellem
SLACs højhastighedselektronkamera filmer molekylær film i HDForskere skabte den første film med atomopløsning af ringåbningsreaktionen af 1, 3-cyclohexadien (CHD) med et elektronkamera kaldet UED. Nederst:UED-elektronstrålen måler nøjagtigt afstandene mellem -
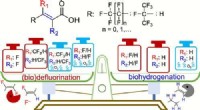 Under anaerobe forhold kan almindelige mikrobielle samfund bryde den ultra-stærke kulstof-fluor-bin…Kredit:Yaochun Yu et al., Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c05509 Ingeniører ved University of California Riverside er de første til at rapportere selektiv nedbrydning
Under anaerobe forhold kan almindelige mikrobielle samfund bryde den ultra-stærke kulstof-fluor-bin…Kredit:Yaochun Yu et al., Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c05509 Ingeniører ved University of California Riverside er de første til at rapportere selektiv nedbrydning
- Ioniske forbindelser er normalt, hvor fysisk tilstand ved stuetemperatur?
- Usædvanligt store mængder vintersne på den nordlige halvkugle i år
- Mexicos Yucatan-halvø afslører et kryptisk metandrevet økosystem i oversvømmede huler
- Hvad er Andesitisk magma lavet af?
- Resterne af skorpen, der ikke var dækket af lava eller affald?
- En kæmpe, en sydende planet kan kredse om stjernen Vega


