Beregn dissocieringskonstanten ved samme temperatur, da pH på en 0,001 monobasinsyre er 4,22 25 grader celsius?
1. Forstå forholdet
* ph og [H+] :PH af en opløsning er relateret til koncentrationen af brintioner ([H+]) ved ligningen:pH =-log [H+].
* ka og dissociation :Dissocieringskonstanten (KA) er et mål for, i hvilket omfang en syre dissocierer i opløsning. For en monobasinsyre (HA) er dissocieringsreaktionen og Ka -ekspression:
Ha (aq) ⇌ h + (aq) + a- (aq)
Ka =[H+] [a-] / [ha]
2. Beregn [H+]
* Brug pH til at finde [H+]:
[H+] =10^(-ph) =10^(-4,22) =6,03 x 10^(-5) m
3. Opret et isbord
* i :Indledende koncentrationer
* C :Ændring i koncentrationer
* e :Ligevægtskoncentrationer
| | Ha | H+ | A- |
| ----- | -------- | --------- | --------- |
| I | 0,001 | 0 | 0 |
| C | -x | +x | +x |
| E | 0,001-X | X | X |
4. Erstatter værdier i ka -ekspression
* Ka =[H+] [a-] / [ha]
* Ka =(x) (x) / (0,001-x)
5. Da syren er svag, skal du antage x <<0,001
* Dette forenkler ligningen:ka ≈ x² / 0,001
6. Løs for X (som er lig med [H+])
* x² =ka * 0,001
* x =√ (ka * 0,001)
* Vi kender x =6,03 x 10^(-5) m (fra trin 2)
7. Beregn Ka
* 6,03 x 10^(-5) =√ (ka * 0,001)
* (6,03 x 10^(-5)) ² =ka * 0,001
* Ka =(6,03 x 10^(-5)) ² / 0,001
* ka ≈ 3,64 x 10^(-6)
Derfor er dissocieringskonstanten (KA) af monobasinsyren ved 25 grader Celsius ca. 3,64 x 10^(-6).
Sidste artikelHvad er den ædle gasnotation af beryllium?
Næste artikelHvad er oxidationstilstanden for NACucl2?
 Varme artikler
Varme artikler
-
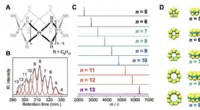 En forberedende reaktion ved hjælp af platinklynger med en encifret atomicitet realiseretFigur (A) viser kompleksernes kemiske struktur, (B) viser kromatogrammet for HPLC -adskillelsen med størrelsesekskluderingskolonner, (C) viser MALDI-TOF-massespektre for de isolerede platinkomplekser
En forberedende reaktion ved hjælp af platinklynger med en encifret atomicitet realiseretFigur (A) viser kompleksernes kemiske struktur, (B) viser kromatogrammet for HPLC -adskillelsen med størrelsesekskluderingskolonner, (C) viser MALDI-TOF-massespektre for de isolerede platinkomplekser -
 Opskalering af tannin-varmtvandsudvindingKredit:BBEPP Rehap kortlagde for nylig den rigelige forsyning af skovbrugsaffald i Europa, og hvor det mest bæredygtigt kan hentes fra. Med denne viden, Projektstudier har forsket i den bedst egne
Opskalering af tannin-varmtvandsudvindingKredit:BBEPP Rehap kortlagde for nylig den rigelige forsyning af skovbrugsaffald i Europa, og hvor det mest bæredygtigt kan hentes fra. Med denne viden, Projektstudier har forsket i den bedst egne -
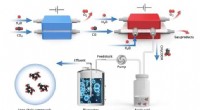 Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen
Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen -
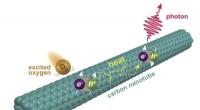 Kemikere får et kig på ny fluorescens i kulstofnanorørKemikere ved Rice University har opdaget et andet niveau af fluorescens i enkeltvæggede kulstofnanorør. Fluorescensen udløses, når oxygenmolekyler exciteret til en singlettilstand interagerer med nano
Kemikere får et kig på ny fluorescens i kulstofnanorørKemikere ved Rice University har opdaget et andet niveau af fluorescens i enkeltvæggede kulstofnanorør. Fluorescensen udløses, når oxygenmolekyler exciteret til en singlettilstand interagerer med nano


