Hvordan adskiller det forbindelsesnatriumchlorid sig fra elementer, hvoraf det komponeres?
1. Fysiske egenskaber:
* natrium: Et blødt, sølvholdigt hvidt metal, der er meget reaktivt og reagerer voldsomt med vand.
* klor: En giftig, grønlig gul gas med en skarp lugt.
* natriumchlorid: Et hvidt, krystallinsk fast stof, der let er opløseligt i vand og har en salt smag.
2. Kemiske egenskaber:
* natrium: Meget reaktive og let danner ioniske bindinger med ikke -metaller.
* klor: Meget reaktiv og et stærkt oxidationsmiddel.
* natriumchlorid: En stabil, ionisk forbindelse med et højt smeltepunkt og kogepunkt. Det er ikke-reaktivt og udfører ikke elektricitet i fast tilstand.
3. Binding:
* natrium: Findes som individuelle atomer med en enkelt valenselektron.
* klor: Findes som individuelle atomer med syv valenselektroner.
* natriumchlorid: Natrium- og kloratomer interagerer for at danne en ionisk binding. Natrium mister sin valenselektron til klor og bliver et positivt ladet natriumion (Na+). Klor vinder elektronet og bliver en negativt ladet chloridion (Cl-). Disse modsatte ladede ioner tiltrækker hinanden og danner en stabil krystallinsk struktur.
Kortfattet:
Natriumchlorid er en helt anden forbindelse end dets bestanddele. Kombinationen af natrium og klor resulterer i et stof med helt forskellige fysiske, kemiske og bindingsegenskaber. Denne transformation eksemplificerer, hvordan kombination af elementer i en kemisk reaktion kan skabe en forbindelse med nye og unikke egenskaber.
 Varme artikler
Varme artikler
-
 Hvordan dannes dis? Sod som en overraskende kilde til dis-opbyggende hydroxylradikalerKredit:© Wiley-VCH Uklarhed dannes, når en cocktail af forskellige gasformige forurenende stoffer oxideres og danner partikler, der spreder sollys. Denne proces er hovedsageligt medieret af hydroxy
Hvordan dannes dis? Sod som en overraskende kilde til dis-opbyggende hydroxylradikalerKredit:© Wiley-VCH Uklarhed dannes, når en cocktail af forskellige gasformige forurenende stoffer oxideres og danner partikler, der spreder sollys. Denne proces er hovedsageligt medieret af hydroxy -
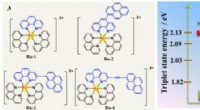 Finjustering af den exciterede tilstand af Ru(II)-fotosensibilisatorer til at øge kuldioxidomdannel…(Venstre) Molekylær struktur af Ru-1-Ru-4. (Højre) Energidiagram over triplettilstande af Ru-1, og L-2-L-4. Kredit:©Science China Press Soldrevet reduktion af CO 2 til energirige brændstoffer, s
Finjustering af den exciterede tilstand af Ru(II)-fotosensibilisatorer til at øge kuldioxidomdannel…(Venstre) Molekylær struktur af Ru-1-Ru-4. (Højre) Energidiagram over triplettilstande af Ru-1, og L-2-L-4. Kredit:©Science China Press Soldrevet reduktion af CO 2 til energirige brændstoffer, s -
 Bedre forståelse af naturens nanomaskiner kan hjælpe med design af fremtidige lægemidlerMartin Schmeing, Lektor ved Institut for Biokemi ved McGill University og hans team har fået en bedre forståelse af, hvordan naturens nanomaskiner fungerer. Det er information, der kan hjælpe med desi
Bedre forståelse af naturens nanomaskiner kan hjælpe med design af fremtidige lægemidlerMartin Schmeing, Lektor ved Institut for Biokemi ved McGill University og hans team har fået en bedre forståelse af, hvordan naturens nanomaskiner fungerer. Det er information, der kan hjælpe med desi -
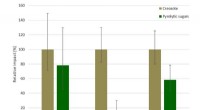 Bæredygtighed af nyt creosotalternativ bekræftetKredit:BTG Biomass Technology Group En nylig offentliggjort undersøgelse har bekræftet bæredygtighedsoplysningerne for et nyt biobaseret alternativ til creosot, der er ved at blive udviklet i Bio4
Bæredygtighed af nyt creosotalternativ bekræftetKredit:BTG Biomass Technology Group En nylig offentliggjort undersøgelse har bekræftet bæredygtighedsoplysningerne for et nyt biobaseret alternativ til creosot, der er ved at blive udviklet i Bio4
- Forskere kortlægger proteinnetværkets dynamik under celledeling
- Hvordan ændrer ubalancerede kræfter hastigheden?
- Ny højhastighedsmetode til spektroskopiske målinger
- Amazon infiltrerede eBays e-mail-system for at finde topsælgere i global konspiration:Retssag
- Hvad er forskellen mellem størrelsesorden og retning af en objekter hastighed?
- Hvad er højden af bølge kendt som?


