Hvorfor ammoniak har et højere kogepunkt og derefter phosphin?
1. Hydrogenbinding:
* Ammoniak kan danne hydrogenbindinger på grund af den høje elektronegativitet af nitrogen og tilstedeværelsen af ensomme par elektroner.
* Hydrogenbindinger er stærke intermolekylære kræfter, der kræver en betydelig mængde energi for at bryde, hvilket fører til et højere kogepunkt.
* Fosfin på den anden side kan ikke danne hydrogenbindinger, fordi fosfor er mindre elektronegativ end nitrogen, og P-H-bindingen er mindre polær.
2. Molekylær form:
* Ammoniak har en pyramidal form med et ensomt par elektroner på nitrogenatomet. Dette ensomme par bidrager til molekylets polaritet og styrker hydrogenbinding.
* Phosphine har en trigonal pyramidal form men er mindre polær end ammoniak på grund af den større størrelse af phosphoratomet.
3. Molekylvægt:
* Mens molekylvægt spiller en rolle i kogepunktet, er det mindre betydningsfuldt i dette tilfælde. Ammoniak og phosphin har lignende molekylvægte.
Kortfattet:
Ammoniakens evne til at danne stærke brintbindinger på grund af dens polære natur og ensomme par elektroner er den primære årsag til dets højere kogepunkt sammenlignet med phosphin.
Sidste artikelHvad er atomnummeret på H2O?
Næste artikelHvad hedder Compound CR3N2?
 Varme artikler
Varme artikler
-
 Fremstilling af aluminiumslegering nu 50 % mere energieffektivBilleder af aluminiumslegering 7075 taget med et scanningselektronmikroskop før (A), under (B) og efter (C) gennemgang af ShaPE-maskinen viser, hvordan legeringens mikrostruktur ændrer sig dramatisk u
Fremstilling af aluminiumslegering nu 50 % mere energieffektivBilleder af aluminiumslegering 7075 taget med et scanningselektronmikroskop før (A), under (B) og efter (C) gennemgang af ShaPE-maskinen viser, hvordan legeringens mikrostruktur ændrer sig dramatisk u -
 Madrester får et dristigt nyt livKredit:University of Tokyo De fleste mennesker tænker ikke meget over de madrester, de smider; imidlertid, forskere fra Institute of Industrial Science ved University of Tokyo har udviklet en ny m
Madrester får et dristigt nyt livKredit:University of Tokyo De fleste mennesker tænker ikke meget over de madrester, de smider; imidlertid, forskere fra Institute of Industrial Science ved University of Tokyo har udviklet en ny m -
 Kemikere bruger massespektrometriværktøjer til at bestemme alder på fingeraftrykKemikerne Young-Jin Lee og Paige Hinners har muligvis fundet en måde at afgøre, hvornår et fingeraftryk blev efterladt. Kredit:Christopher Gannon/Iowa State University Fingeraftryk fortæller os me
Kemikere bruger massespektrometriværktøjer til at bestemme alder på fingeraftrykKemikerne Young-Jin Lee og Paige Hinners har muligvis fundet en måde at afgøre, hvornår et fingeraftryk blev efterladt. Kredit:Christopher Gannon/Iowa State University Fingeraftryk fortæller os me -
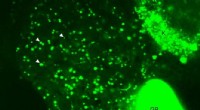 Forskere ser fedtstofskiftet i levende fisk, observere lipidbiokemi i realtidEt levende billede af leveren af en gennemskinnelig, larve zebrafisk. Det er taget ved hjælp af konfokal mikroskopi, som giver mulighed for klare billeder af de indre organer af et helt levende dyr.
Forskere ser fedtstofskiftet i levende fisk, observere lipidbiokemi i realtidEt levende billede af leveren af en gennemskinnelig, larve zebrafisk. Det er taget ved hjælp af konfokal mikroskopi, som giver mulighed for klare billeder af de indre organer af et helt levende dyr.
- Hvordan ser planeten Jupiter ud?
- Hvad kalder du elektricitet genereret ved hjælp af vand fra reservoirer?
- Hacking af det bakterielle sociale netværk
- Hvad udgør jord udover stenpartikler og mineraler luftvand?
- Hvor meget propan bruges til at opvarme en 50 gallon vandvarmer fra 75 grader 105 grader?
- Hvad er 0,0075 i videnskabelig notation?


