Hvor mange gram jern II -sulfid skal reagere med saltsyre generere 12 g hydrogensulfid?
1. Skriv den afbalancerede kemiske ligning:
FES (S) + 2 HCI (AQ) → FECL₂ (AQ) + H₂S (G)
2. Beregn den molære masse af hydrogensulfid (H₂S):
* H:1,01 g/mol (x2 =2,02 g/mol)
* S:32,07 g/mol
* I alt:34,09 g/mol
3. Beregn molen af hydrogensulfid:
* Mol =masse / molær masse
* Mol H₂s =12 g / 34,09 g / mol =0,352 mol
4. Brug molforholdet fra den afbalancerede ligning til at finde molen af jern II -sulfid (FES):
* Ligningen viser et forhold på 1:1 mol mellem FES og H₂S.
* Derfor er der behov for 0,352 mol FES.
5. Beregn massen af jern II -sulfid:
* Molær masse af fes:
* FE:55,85 g/mol
* S:32,07 g/mol
* I alt:87,92 g/mol
* Masse =mol x molmasse
* Masse FES =0,352 mol x 87,92 g/mol =30,9 g
Derfor er der behov for ca. 30,9 gram jern II -sulfid for at reagere med saltsyre for at generere 12 gram hydrogensulfid.
 Varme artikler
Varme artikler
-
 Nye molekylære prober til opioidreceptorerVed hjælp af specielle ligander, det var muligt at bevise, at opioidreceptorer også er til stede som par af to i cellemembranen. Kredit:Scigraphix Stærke smertestillende midler er meget vigtige i
Nye molekylære prober til opioidreceptorerVed hjælp af specielle ligander, det var muligt at bevise, at opioidreceptorer også er til stede som par af to i cellemembranen. Kredit:Scigraphix Stærke smertestillende midler er meget vigtige i -
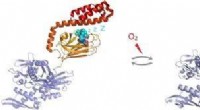 S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-termi…Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det s
S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-termi…Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det s -
 Planteinspirerede alkaloider beskytter ris, kiwi og citrus fra skadelige bakterierKredit:Pixabay/CC0 Public Domain Planter får bakterielle infektioner, ligesom mennesker gør. Når madafgrøder og træer er inficeret, deres udbytte og kvalitet kan lide. Selvom nogle forbindelser er
Planteinspirerede alkaloider beskytter ris, kiwi og citrus fra skadelige bakterierKredit:Pixabay/CC0 Public Domain Planter får bakterielle infektioner, ligesom mennesker gør. Når madafgrøder og træer er inficeret, deres udbytte og kvalitet kan lide. Selvom nogle forbindelser er -
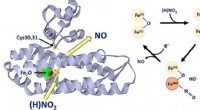 Identifikation af enzym involveret i stresshåndtering hos bakterierGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.1c12407 Forskere fra University of East Anglia har identificeret en ny klasse af enzymer involveret i stre
Identifikation af enzym involveret i stresshåndtering hos bakterierGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.1c12407 Forskere fra University of East Anglia har identificeret en ny klasse af enzymer involveret i stre
- Hvis en rød stjerne og hvid udstråler energi i samme hastighed, kan de være størrelse, ikke hvil…
- Hvilken kraft fungerer på flyet i en afstand A. træk B. skubb C. løft D. vægt?
- Video:Hvordan måler vi temperatur?
- Supercomputing dynamiske jordskælvsbrudmodeller
- Naturens tendens til at gå mod en statsforstyrrelse kaldes?
- Pulsdrevet robot:Bevægelse via solitære bølger


