Kan stabil forbindelse fremstilles af ilt og lithium?
Her er hvorfor:
* Elektrostatisk attraktion: Lithium er et meget elektropositivt element (har en tendens til at miste elektroner), mens ilt er meget elektronegativt (har en tendens til at vinde elektroner). Denne forskel i elektronegativitet fører til en stærk elektrostatisk attraktion mellem lithium- og iltioner og danner en ionisk binding.
* ionisk binding: Lithiumoxid er en ionisk forbindelse, hvor lithiumatomer mister et elektron hver til dannelse af li⁺ioner, og iltatomer får to elektroner hver til dannelse af o²⁻ioner. Disse ioner arrangerer derefter sig i en krystalgitterstruktur, der holdes sammen af elektrostatiske kræfter.
egenskaber ved lithiumoxid:
* Hvidt fast stof: Lithiumoxid er et hvidt, krystallinsk fast stof ved stuetemperatur.
* højt smeltepunkt: Det har et højt smeltepunkt på 1570 ° C på grund af den stærke ioniske binding.
* reagerer med vand: Lithiumoxid reagerer kraftigt med vand til dannelse af lithiumhydroxid (LIOH) og frigiver varme.
Anvendelser af lithiumoxid:
* keramik: Det bruges til produktion af keramik, glas og emaljer.
* Batterier: Lithiumoxid er en komponent i nogle typer lithium-ion-batterier.
* smøremidler: Det bruges som et smøremiddel med høj temperatur.
Så som konklusion er lithiumoxid en stabil forbindelse dannet af reaktionen af lithium og ilt, og det finder forskellige anvendelser i forskellige brancher.
Sidste artikelHvilken farve er det, når du blander vand og calciumchlorid?
Næste artikelHvad er massen i gram på 6,25 mol kobber II -nitrat?
 Varme artikler
Varme artikler
-
 Enzymopdagelse kan hjælpe med at bekæmpe tuberkuloseKredit:University of Warwick En enzymstruktur opdagelse foretaget af forskere ved University of Warwick kan hjælpe med at udrydde tuberkulose (TB). Forskning udført af et hold ledet af Dr. Elizab
Enzymopdagelse kan hjælpe med at bekæmpe tuberkuloseKredit:University of Warwick En enzymstruktur opdagelse foretaget af forskere ved University of Warwick kan hjælpe med at udrydde tuberkulose (TB). Forskning udført af et hold ledet af Dr. Elizab -
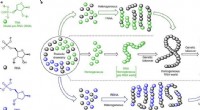 Forskere foreslår, at RNA og DNA startede med RNA-DNA-kimæreren, Konstitutionel formelrepræsentation af de tre oligonukleotid -byggesten, der blev undersøgt i denne undersøgelse. b, Tre mulige scenarier for fremkomsten af RNA og DNA fra præbiotisk kemi. Midt:
Forskere foreslår, at RNA og DNA startede med RNA-DNA-kimæreren, Konstitutionel formelrepræsentation af de tre oligonukleotid -byggesten, der blev undersøgt i denne undersøgelse. b, Tre mulige scenarier for fremkomsten af RNA og DNA fra præbiotisk kemi. Midt: -
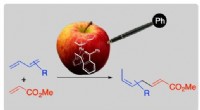 Phenyltilsætning gjorde en gift nyttig til en kemisk reaktion i katalyseTag for eksempel et forgiftet æble, det kan udsende en berusende blød aroma bare ved at stikke en kuglepen og skifte til at være lækker. Kreditering:Figur tilpasset med tilladelse fra Organometallics,
Phenyltilsætning gjorde en gift nyttig til en kemisk reaktion i katalyseTag for eksempel et forgiftet æble, det kan udsende en berusende blød aroma bare ved at stikke en kuglepen og skifte til at være lækker. Kreditering:Figur tilpasset med tilladelse fra Organometallics, -
 Nyt proteinstudie udvider kendskabet til molekylært grundlag for sygdomPatricia Clark, pastor John Cardinal OHara C.S.C. Professor i kemi og biokemi ved Notre Dame, arbejdede sammen med Tobin Sosnick, professor og formand for Institut for Biokemi og Molekylærbiologi ved
Nyt proteinstudie udvider kendskabet til molekylært grundlag for sygdomPatricia Clark, pastor John Cardinal OHara C.S.C. Professor i kemi og biokemi ved Notre Dame, arbejdede sammen med Tobin Sosnick, professor og formand for Institut for Biokemi og Molekylærbiologi ved
- Atomer af to eller flere elementer, der er kemisk kombineret, er?
- Skriv et kort essay, hvor du opretter en analogi til at beskrive partikelbevægelse. Sammenlign bevæ…
- Hvad hedder den kemiske reaktion MN?
- Hvor var du, da Apollo 11 landede? Ikke født endnu
- Oliespildskatastrofer i de sidste 50 år
- Video:Hold øje med havets plastikforurening fra rummet


