Hvordan tegner du et brint?
1. Bohr -modellen:
* cirkel: Tegn en cirkel for at repræsentere kernen i hydrogenatomet.
* prik: Inde i cirklen skal du placere en lille prik for at repræsentere protonen (den positivt ladede partikel).
* mindre cirkel: Tegn en meget større cirkel omkring den første cirkel for at repræsentere elektronskalen.
* mindre prik: Placer en mindre prik på den ydre cirkel for at repræsentere elektronet (den negativt ladede partikel).
2. Den kvantemekaniske model:
* kerne: Tegn en lille cirkel for at repræsentere kernen.
* sky: I stedet for en defineret bane, skal du tegne en uklar, skylignende form omkring kernen for at repræsentere sandsynligheden for at finde elektronet i det rum.
Vigtige overvejelser:
* skala: Disse modeller skal ikke skaleres. Elektronskallen i BoHR -modellen er meget større end kernen, men i virkeligheden er kernen meget, meget mindre sammenlignet med det rum, hvor elektronet sandsynligvis findes.
* forenklet: Disse modeller er forenklede repræsentationer. Den faktiske opførsel af elektroner i atomer er mere kompleks og beskrives af kvantemekanik.
Her er nogle eksempler:
* Bohr Model:
;
* kvantemekanisk model:
;
Fortæl mig, hvis du har andre spørgsmål.
Sidste artikelEr hydrogen og sulfid den samme ting?
Næste artikelHvordan adskiller partikler i opløsninger sig fra denne suspension?
 Varme artikler
Varme artikler
-
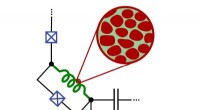 Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin
Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin -
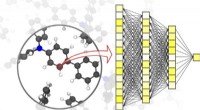 Maskinlæring fremskynder simuleringer inden for materialevidenskabNeurale netværk muliggør præcise simuleringer inden for materialevidenskab – ned til niveauet af individuelle atomer. Kredit:Pascal Friedrich, SÆT Forskning, udvikling, og produktion af nye materi
Maskinlæring fremskynder simuleringer inden for materialevidenskabNeurale netværk muliggør præcise simuleringer inden for materialevidenskab – ned til niveauet af individuelle atomer. Kredit:Pascal Friedrich, SÆT Forskning, udvikling, og produktion af nye materi -
 Forskere rapporterer om en ny og bedre form for usynlig blækDigitale billeder af det trykte logo fra Shanghai Jiao Tong University på et kommercielt pergamentpapir før og efter saltpåfyldning under omgivende og UV-lys. Kredit:Li et al, Naturkommunikation
Forskere rapporterer om en ny og bedre form for usynlig blækDigitale billeder af det trykte logo fra Shanghai Jiao Tong University på et kommercielt pergamentpapir før og efter saltpåfyldning under omgivende og UV-lys. Kredit:Li et al, Naturkommunikation -
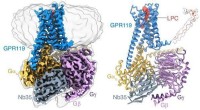 Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119Identifikation af LPCet bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en
Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119Identifikation af LPCet bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en


