Hvad er intermolekylære brintbindinger?
Intermolekylære brintbindinger:En stærk attraktion
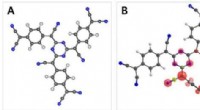
Intermolekylære brintbindinger er en specifik type dipol-dipol-interaktion der forekommer mellem molekyler. De er stærkere end typiske dipol-dipol-interaktioner og endnu stærkere end London-spredningskræfter.
Her er en sammenbrud:
* Hvad er en brintbinding? Det er en attraktion mellem et hydrogenatom Kovalent bundet til et meget elektronegativt atom (som ilt, nitrogen eller fluor) og et ensomt par elektroner På et andet elektronegativt atom.
* Intermolekylær betyder, at obligationen forekommer mellem Forskellige molekyler, ikke inden for det samme molekyle.
* hvorfor er de stærke? Det elektronegative atom trækker det delte elektronpar i den kovalente binding tættere på sig selv, hvilket efterlader brintatomet med en delvis positiv ladning (Δ+). Det ensomme par på det andet elektronegative atom har en delvis negativ ladning (Δ-). Denne stærke elektrostatiske attraktion mellem Δ+ og Δ- skaber brintbindingen.
Nøgleegenskaber:
* retningsbestemt: Hydrogenbindinger er retningsbestemte og dannes i en bestemt orientering, hvilket skaber en lineær form.
* svag sammenlignet med kovalente obligationer: Mens de er stærke blandt intermolekylære kræfter, er brintbindinger meget svagere end kovalente bindinger.
* afgørende for livet: De spiller en vigtig rolle i adskillige biologiske processer, herunder:
* Vandegenskaber: Højt kogepunkt, høj overfladespænding, fremragende opløsningsmiddelegenskaber
* Proteinstruktur: Stabilisering af 3D -strukturen af proteiner
* DNA -struktur: Holder de to DNA -tråde sammen
* enzymer: Tilvejebringelse af specificitet og katalytisk aktivitet
Eksempler:
* Vand: Hydrogenbindinger dannes mellem iltatomet i et vandmolekyle og hydrogenatomet af en anden.
* DNA: Hydrogenbindinger forbinder basisparene (adenin-thymin og guanin-cytosin) i DNA.
* Proteiner: Hydrogenbindinger hjælper med at folde og opretholde 3D -strukturen af proteiner.
Kort sagt: Intermolekylære brintbindinger er stærke attraktioner mellem molekyler, afgørende for mange biologiske og kemiske processer. De stammer fra den unikke interaktion mellem et hydrogenatom med en delvis positiv ladning og et ensomt par elektroner på et elektronegativt atom.
 Varme artikler
Varme artikler
-
 Organisk ferromagnetisme:Fældning spinder i den glasagtige tilstand af en organisk netværksstruktu…Et team af forskere, tilknyttet Sydkoreas Ulsan National Institute of Science and Technology (UNIST) præsenterer alternative metoder til alsidige fremtidige anvendelser af plastmagneter. Kredit:UNIST
Organisk ferromagnetisme:Fældning spinder i den glasagtige tilstand af en organisk netværksstruktu…Et team af forskere, tilknyttet Sydkoreas Ulsan National Institute of Science and Technology (UNIST) præsenterer alternative metoder til alsidige fremtidige anvendelser af plastmagneter. Kredit:UNIST -
 For en sand krig mod affald, modeindustrien skal bruge mere på forskningEn model bærer et af forfatterens originale zero waste designs. Stigningen af fast fashion i Australien betyder, at 6000 kg tøj bliver dumpet på lossepladsen hvert 10. minut. ABCs War On Waste v
For en sand krig mod affald, modeindustrien skal bruge mere på forskningEn model bærer et af forfatterens originale zero waste designs. Stigningen af fast fashion i Australien betyder, at 6000 kg tøj bliver dumpet på lossepladsen hvert 10. minut. ABCs War On Waste v -
 Ny metode til isolering af tumorceller kan forbedre kræftforskning og -behandlingLeidong Mao (til venstre), en lektor ved UGA College of Engineering arbejdede sammen med ph.d.-studerende Wujun Zhao om at udvikle en ny enhed, der er i stand til at isolere tumorceller. Kredit:Univer
Ny metode til isolering af tumorceller kan forbedre kræftforskning og -behandlingLeidong Mao (til venstre), en lektor ved UGA College of Engineering arbejdede sammen med ph.d.-studerende Wujun Zhao om at udvikle en ny enhed, der er i stand til at isolere tumorceller. Kredit:Univer -
 En intelligent, formformende, selvhelbredende materiale til integreret kunstig muskel og nervevævForskere udvikler et formformende materiale med en hidtil uset multifunktionalitet til blød robotik og bærbar elektronik. Kredit:Soft Machines Lab, Carnegie Mellon University Fremskridt inden for
En intelligent, formformende, selvhelbredende materiale til integreret kunstig muskel og nervevævForskere udvikler et formformende materiale med en hidtil uset multifunktionalitet til blød robotik og bærbar elektronik. Kredit:Soft Machines Lab, Carnegie Mellon University Fremskridt inden for
- Jeg er et stof, der ikke har noget fast volumen eller form?
- Hvilket brændstof indeholder mest energi?
- Hvilket overgangsmetal har 30 elektroner?
- Hvordan langsomme muskelfibre overbeviser deres naboer om at slutte sig til dem
- Kulstofbinding i havene drevet af fragmentering af store organiske partikler
- Fleksibel elektronisk hud hjælper mennesker-maskine interaktioner


