Hvordan adskiller isotoperne brint 1 og 2 sig?
* hydrogen-1 (¹h) har ingen neutroner . Det består af en proton og en elektron. Dette er den mest almindelige form for brint, der udgør ca. 99,98% af alle hydrogenatomer.
* hydrogen-2 (²h eller d) , også kendt som deuterium, har en neutron Ud over dets ene proton og en elektron. Dette gør det dobbelt så tungt som hydrogen-1.
Her er en tabel, der opsummerer de vigtigste forskelle:
| Isotop | Antal protoner | Antal neutroner | Atommasse | Overflod |
| --- | --- | --- | --- | --- |
| Hydrogen-1 (¹H) | 1 | 0 | 1 | 99,98% |
| Hydrogen-2 (²h eller d) | 1 | 1 | 2 | 0,02% |
Mens begge isotoper har de samme kemiske egenskaber, giver den ekstra neutron i deuterium det lidt forskellige fysiske egenskaber, såsom et højere kogepunkt og densitet.
Sidste artikelEr soda lige åbnet et sammensat element eller en blanding?
Næste artikelHvad er ligningen for nedbrydning af jern 3 -chlorat?
 Varme artikler
Varme artikler
-
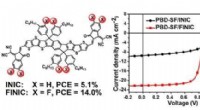 Forskere udvikler fusioneret-ring elektronacceptor med 3-D exciton og ladningstransportDe molekylære strukturer og enhedens ydeevne. Kredit:Peking University For nylig, Professor Zhan Xiaoweis gruppe fra College of Engineering ved Peking University gjorde fremskridt inden for ikke-f
Forskere udvikler fusioneret-ring elektronacceptor med 3-D exciton og ladningstransportDe molekylære strukturer og enhedens ydeevne. Kredit:Peking University For nylig, Professor Zhan Xiaoweis gruppe fra College of Engineering ved Peking University gjorde fremskridt inden for ikke-f -
 Oliefrøafgrøder affaldsprodukt giver forbindelser, der beskytter huden mod solenKredit:Oregon State University Meadowfoam, en indfødt Pacific Northwest-plante dyrket som en oliefrøafgrøde, er opstået som en potentiel ny kilde til beskyttelse mod solens skadelige virkninger på
Oliefrøafgrøder affaldsprodukt giver forbindelser, der beskytter huden mod solenKredit:Oregon State University Meadowfoam, en indfødt Pacific Northwest-plante dyrket som en oliefrøafgrøde, er opstået som en potentiel ny kilde til beskyttelse mod solens skadelige virkninger på -
 Proteser med kontrolleret nedbrydningshastighedUdseende af overfladen af laget af calciumphosphat. Kredit:Nuria Monasterio / UPV / EHU Da magnesiumlegeringer er nedbrydelige, de kunne give et alternativ til de metaller, der traditionelt brug
Proteser med kontrolleret nedbrydningshastighedUdseende af overfladen af laget af calciumphosphat. Kredit:Nuria Monasterio / UPV / EHU Da magnesiumlegeringer er nedbrydelige, de kunne give et alternativ til de metaller, der traditionelt brug -
 Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blandingKredit:CC0 Public Domain Kemikere ved Scripps Research har gjort en opdagelse, der understøtter et overraskende nyt syn på, hvordan liv opstod på vores planet. I en undersøgelse offentliggjort i
Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blandingKredit:CC0 Public Domain Kemikere ved Scripps Research har gjort en opdagelse, der understøtter et overraskende nyt syn på, hvordan liv opstod på vores planet. I en undersøgelse offentliggjort i
- Hvordan videnskabsmænd bruger DNA-test til at forstyrre internationale elfenbenssmuglingsnetværk
- Sådan finder du en brøkdel mellem to fraktioner
- Manglende galaktiske fusioner kommer frem i lyset med ny teknik
- Hvad er en astronormi?
- Hvordan DNA-korrekturlæser-proteiner vælger og redigerer deres læsemateriale
- Hvorfor bruges colchicin til at forberede en metafasespredning?


