Hvad er de 4 egenskaber ved elektrovalent forbindelse?
1. høje smelte- og kogepunkter: Ioniske bindinger er stærke elektrostatiske attraktioner mellem modsat ladede ioner. Denne stærke attraktion kræver en betydelig mængde energi til at bryde, hvilket resulterer i høje smelte- og kogepunkter.
2. opløselighed i polære opløsningsmidler: Ioniske forbindelser har en tendens til at opløses i polære opløsningsmidler som vand. De polære opløsningsmiddelmolekyler kan omringe ionerne, svække den ioniske binding og lade forbindelsen opløses.
3. gode ledere af elektricitet i smeltede eller vandige løsninger: Mens faste ioniske forbindelser er dårlige ledere af elektricitet, bliver de gode ledere, når de er smeltet eller opløst i vand. Dette skyldes, at ionerne er frie til at bevæge sig og bære en elektrisk strøm.
4. sprød natur: Ioniske forbindelser er sprøde, fordi ionerne er arrangeret i en stiv gitterstruktur. Hvis der påføres en kraft, kan ionerne skifte, hvilket får som afgifter til at justere, hvilket fører til stærk frastødelse og brud på krystallen.
Fortæl mig, hvis du gerne vil gå dybere ned i nogen af disse egenskaber!
Sidste artikelHvorfor er natriumhydroxid farligt at bruge?
Næste artikelHvad er formlen for jern II nitrit?
 Varme artikler
Varme artikler
-
 Røntgenlaserundersøgelse identificerer krystallinsk mellemprodukt i vores vej til vejrtrækningAustin Echelmeir (venstre til højre), Alexandra Ros, Petra Fromme og Raimund Fromme alle fra ASUs School of Molecular Sciences og Biodesign Institutes Center for Applied Structural Discovery. Kredit:M
Røntgenlaserundersøgelse identificerer krystallinsk mellemprodukt i vores vej til vejrtrækningAustin Echelmeir (venstre til højre), Alexandra Ros, Petra Fromme og Raimund Fromme alle fra ASUs School of Molecular Sciences og Biodesign Institutes Center for Applied Structural Discovery. Kredit:M -
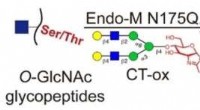 Reversibel kemoenzymatisk mærkningsstrategi muliggør dybdegående analyse af protein O-GlcNAcyleri…Kredit:Angewandte Chemie (2022). DOI:10.1002/ange.202117849 O-bundet β-N-acetylglucosamin (O-GlcNAcylation), en vigtig post-translationel modifikation (PTM) af proteiner, er involveret i forskellig
Reversibel kemoenzymatisk mærkningsstrategi muliggør dybdegående analyse af protein O-GlcNAcyleri…Kredit:Angewandte Chemie (2022). DOI:10.1002/ange.202117849 O-bundet β-N-acetylglucosamin (O-GlcNAcylation), en vigtig post-translationel modifikation (PTM) af proteiner, er involveret i forskellig -
 Den banebrydende kunstige fotosyntese kommer tættere påKredit:Pixabay/CC0 Public Domain Forestil dig, at vi kunne gøre, hvad grønne planter kan:fotosyntese. Så kunne vi få dækket vores enorme energibehov med dybgrøn brint og klimaneutral biodiesel. For
Den banebrydende kunstige fotosyntese kommer tættere påKredit:Pixabay/CC0 Public Domain Forestil dig, at vi kunne gøre, hvad grønne planter kan:fotosyntese. Så kunne vi få dækket vores enorme energibehov med dybgrøn brint og klimaneutral biodiesel. For -
 At studere virale udbrud i enkeltceller kan afsløre nye måder at besejre dem påKredit:CC0 Public Domain Mange vira, herunder hiv og influenza A, muterer så hurtigt, at identifikation af effektive vacciner eller behandlinger er som at forsøge at ramme et bevægeligt mål. En be
At studere virale udbrud i enkeltceller kan afsløre nye måder at besejre dem påKredit:CC0 Public Domain Mange vira, herunder hiv og influenza A, muterer så hurtigt, at identifikation af effektive vacciner eller behandlinger er som at forsøge at ramme et bevægeligt mål. En be
- Menneske-tigerkonflikt:Er risici overvurderet?
- Mediedækning af skyderiet i New Zealand-moskeen skal undersøges, Nordøstlig professor siger
- Teoretisk model afslører, hvordan dråber vokser omkring små partikler på en overflade
- Giv to bevismateriale for spredning af havbunden?
- Biologi og neutroner støder sammen for at låse fiskens ørebenes hemmeligheder op
- Ville du finde protein inde i celler eller proteiner?


