Hvorfor ikke natriumchlorid krystal adfærd elektricitet?
* ionisk binding: Natriumchlorid (NaCI) holdes sammen af ioniske bindinger. Dette betyder, at natriumionerne (Na+) og chloridioner (Cl-) er stærkt tiltrukket af hinanden på grund af elektrostatiske kræfter.
* faste positioner: Disse ioner er låst i en stiv, krystallinsk gitterstruktur. De er ikke frie til at bevæge sig rundt.
* Ingen gratis opladningsbærere: For at udføre elektricitet skal ladede partikler være i stand til at bevæge sig frit. Da ionerne i en natriumchloridkrystall er fikseret, kan de ikke bære en elektrisk strøm.
Natriumchlorid Foretager elektricitet, når den opløses i vand eller smeltet.
* opløste: Når natriumchlorid opløses i vand, brydes de ioniske bindinger, og ionerne bliver frie til at bevæge sig rundt i opløsningen.
* smeltning: Når natriumchlorid smelter, fastgøres ionerne ikke længere i gitterstrukturen og kan bevæge sig frit.
I begge tilfælde muliggør den frie bevægelse af ladede ioner ledning af elektricitet.
Sidste artikelHvad er den kemiske formel for kobberpyrit?
Næste artikelEr nitrat en fast væske eller gas?
 Varme artikler
Varme artikler
-
 Molekylær dynamiksimulering kaster nyt lys over metanhydratdannelseMethanhydrat hentet fra havbunden ud for Oregons kyst, USA. Kredit:Wikimedia Commons I et papir, der blev offentliggjort i denne uge i PNAS , forskere ved University of Amsterdams Van t Hoff Ins
Molekylær dynamiksimulering kaster nyt lys over metanhydratdannelseMethanhydrat hentet fra havbunden ud for Oregons kyst, USA. Kredit:Wikimedia Commons I et papir, der blev offentliggjort i denne uge i PNAS , forskere ved University of Amsterdams Van t Hoff Ins -
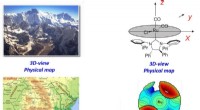 Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne
Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne -
 Kuldioxidreduktion på Jorden og magnesiumcivilisation på MarsBoble luften i vand med en knivspids magnesium, og vi får brændstof. Kredit:Vivek Polshettiwar Overdreven CO 2 emissioner er en væsentlig årsag til klimaændringer, og dermed reducere CO 2 nive
Kuldioxidreduktion på Jorden og magnesiumcivilisation på MarsBoble luften i vand med en knivspids magnesium, og vi får brændstof. Kredit:Vivek Polshettiwar Overdreven CO 2 emissioner er en væsentlig årsag til klimaændringer, og dermed reducere CO 2 nive -
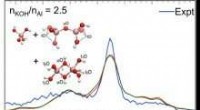 Aluminiumskomplekser identificeret via vibrationsfingeraftrykRamanspektre af opløsninger sammensat af en aluminatmonomer og to dimere arter. Vibrationsbånd forudsagt af ab-initio molekylær dynamik (AIMD) vist i rødt og grønt. Overlappende IR- og Raman-bånd får
Aluminiumskomplekser identificeret via vibrationsfingeraftrykRamanspektre af opløsninger sammensat af en aluminatmonomer og to dimere arter. Vibrationsbånd forudsagt af ab-initio molekylær dynamik (AIMD) vist i rødt og grønt. Overlappende IR- og Raman-bånd får
- Hvad er fysikken involveret i faldskærmsudspring?
- Hvor mange cm i 67 mm?
- Islinser kan forårsage mange arktiske jordskred
- Smashing guld med finesse:Stødfri kompressionseksperimenter etablerer nye trykskalaer
- Hvorfor er havet forskellige farver forskellige steder?
- Forskere undersøger, hvordan borgere kan blive agenter for miljøændringer


