Hvor mange uparrede elektroner er der i den ydre elektronskal af klor?
1. Elektronisk konfiguration:
* Chlor har et atomnummer på 17, hvilket betyder, at det har 17 elektroner.
* Dens elektroniske konfiguration er:1S² 2s² 2p⁶ 3S² 3P⁵
2. Yderste skal:
* Den yderste skal er den tredje skal (n =3).
* Det har 7 elektroner i det (3S² 3P⁵).
3. Fyldning af p-orbitaler:
* 3P -underskalet har 3 orbitaler (3px, 3py, 3PZ). Hver orbital kan indeholde maksimalt 2 elektroner.
* 3P -underskalet i klor har 5 elektroner. Disse elektroner vil fylde orbitaler individuelt (Hunds regel), før de fordobles.
4. Uparrede elektroner:
* Dette betyder, at der er en uparret elektron I kloren 3p af klor.
Derfor har klor en uparret elektron i sin ydre elektronskal.
 Varme artikler
Varme artikler
-
 Eleven bruger planteaffald til at skabe et bæredygtigt alternativ til farvestofKredit:Imperial College London Kejserstuderende Nicole Stjernswärd bruger planteaffald til at skabe naturlige pulverpigmenter, der kan bruges til maling, blæk eller tekstiler. Historisk set kom f
Eleven bruger planteaffald til at skabe et bæredygtigt alternativ til farvestofKredit:Imperial College London Kejserstuderende Nicole Stjernswärd bruger planteaffald til at skabe naturlige pulverpigmenter, der kan bruges til maling, blæk eller tekstiler. Historisk set kom f -
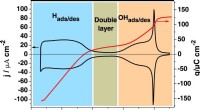 Ny forståelse af nøglebrændselscellekatalysatorTopmoderne for Pt(111). Cyklisk voltammogram (sort linje, venstre akse) og ladningstæthedskurve (rød linje, højre akse) for Pt (111) optaget i 0,1 M HClO4-opløsning ved en scanningshastighed på 50 mV
Ny forståelse af nøglebrændselscellekatalysatorTopmoderne for Pt(111). Cyklisk voltammogram (sort linje, venstre akse) og ladningstæthedskurve (rød linje, højre akse) for Pt (111) optaget i 0,1 M HClO4-opløsning ved en scanningshastighed på 50 mV -
 Video:Coronavirus-vaccine:Hvor er vi, og hvad er det næste?Kredit:The American Chemical Society Du har måske hørt, at COVID-19-vaccineforsøg er i gang i Seattle. Hvad er det præcist, der testes? Hvor meget længere vil disse test tage? Og hvornår kan vi f
Video:Coronavirus-vaccine:Hvor er vi, og hvad er det næste?Kredit:The American Chemical Society Du har måske hørt, at COVID-19-vaccineforsøg er i gang i Seattle. Hvad er det præcist, der testes? Hvor meget længere vil disse test tage? Og hvornår kan vi f -
 Computermodellering af WNK-kinasehæmmere kunne tilbyde nye værktøjer til at forstå hypertensionKredit:North Carolina State University Forskere fra North Carolina State University har modelleret og analyseret bindingsmåderne for 210 molekyler, der tidligere er rapporteret at hæmme funktionen
Computermodellering af WNK-kinasehæmmere kunne tilbyde nye værktøjer til at forstå hypertensionKredit:North Carolina State University Forskere fra North Carolina State University har modelleret og analyseret bindingsmåderne for 210 molekyler, der tidligere er rapporteret at hæmme funktionen
- Hvorfor bruges sølv- og guldmetaller?
- Magnonic nano-fibre åbner vejen mod nye typer computere
- Et stofs frysepunkt er altid lavere end det?
- Forskere afslører, hvordan molekylære vejspærringer bremser nedbrydningen af cellulose til biob…
- Hvordan drager jorden til fordel for solen?
- Hvordan holder Van Der Waals Force Hold Molecules Together?


