Hvad sker der på molekylært niveau, når et stof fryser?
1. Fra forstyrrelse til orden:
* flydende tilstand: Molekyler i en væske er relativt langt fra hinanden og bevæger sig frit og kolliderer konstant med hinanden. De har betydelig kinetisk energi (bevægelsesenergi).
* Frysning: Når en væske afkøles, mister dens molekyler kinetisk energi og bremser. De svagere intermolekylære kræfter (som van der Waals -styrker eller brintbindinger), der normalt kun forårsager midlertidige attraktioner, bliver nu stærkere.
* Krystallisation: Molekylerne begynder at arrangere sig selv i et meget ordnet, gentagne mønster kaldet en krystalgitter. Denne struktur minimerer systemets potentielle energi.
2. Rollen af intermolekylære kræfter:
* attraktion: Styrken af intermolekylære kræfter mellem molekyler bestemmer et stofs frysepunkt. Stærkere kræfter fører til højere frysepunkter. For eksempel har vand et relativt højt frysepunkt på grund af stærke brintbindinger mellem dets molekyler.
* Gitterdannelse: Det specifikke arrangement af molekyler inden for krystalgitteret dikteres af typen og styrken af intermolekylære kræfter. Forskellige stoffer danner forskellige krystalstrukturer.
3. Energiændringer:
* eksotermisk proces: Frysning er en eksoterm proces, hvilket betyder, at varme frigøres fra stoffet, når det ændrer tilstand. Denne varme er den energi, der tidligere blev opbevaret i molekylerne i flydende tilstand.
* entalpi af fusion: Mængden af varme, der frigives under frysning, kaldes fusionens entalpi. Det er den samme mængde varme, der kræves for at smelte den samme mængde af stoffet.
4. Eksempler:
* Vand: Vandmolekyler danner en hexagonal krystalgitter med brintbindinger, der holder dem sammen.
* Metaller: Metalatomer arrangerer sig i et tæt pakket, regelmæssigt gitter.
* Gasser: Mange gasser, som nitrogen og ilt, bliver væsker og derefter faste stoffer ved ekstremt lave temperaturer.
5. Undtagelser:
* amorfe faste stoffer: Nogle stoffer, som glas, fryser uden at danne en krystalgitter. Deres molekyler bliver mindre mobile, men arrangerer sig ikke i et almindeligt mønster.
* superkøling: Under visse betingelser kan en væske afkøles under dens frysepunkt uden frysning. Dette kaldes superkøling og er en metastabil tilstand.
I det væsentlige er frysning et dramatisk skift i et stofs molekylære opførsel. Molekyler går fra en forstyrret, højenergitilstand til en meget ordnet, lavenergi-tilstand, drevet af styrken af intermolekylære kræfter og frigivelse af varmeenergi.
Sidste artikelKemisk formel af natriumpalmekernelat?
Næste artikelHvordan balanserer du Zn plus HCL --- ZnCl2 H2?
 Varme artikler
Varme artikler
-
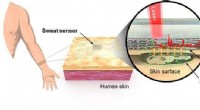 Hurtig, pålidelig lægemiddeldetektion på stedet ved hjælp af en bærbar sensorMedikamentdetektion i realtid ved hjælp af en optisk sensor fastgjort til den menneskelige hud. Kredit:Korea Institute of Materials Science (KIMS) Forskere i Sydkorea har med succes udviklet en bæ
Hurtig, pålidelig lægemiddeldetektion på stedet ved hjælp af en bærbar sensorMedikamentdetektion i realtid ved hjælp af en optisk sensor fastgjort til den menneskelige hud. Kredit:Korea Institute of Materials Science (KIMS) Forskere i Sydkorea har med succes udviklet en bæ -
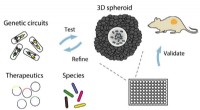 Forskere udvikler en ny platform, der genskaber kræft i et fad for hurtigt at bestemme den bedste b…Bakterier koloniserer multicellulære sfæroider in vitro, hvor de screenes for vækst, kredsløb dynamik, og terapeutisk effekt og derefter valideres i musetumormodeller. Kredit:Tetsuhiro Harimoto/Columb
Forskere udvikler en ny platform, der genskaber kræft i et fad for hurtigt at bestemme den bedste b…Bakterier koloniserer multicellulære sfæroider in vitro, hvor de screenes for vækst, kredsløb dynamik, og terapeutisk effekt og derefter valideres i musetumormodeller. Kredit:Tetsuhiro Harimoto/Columb -
 Ny metode til mikrobiel energiproduktion opdagetPaul King, David Mulder og Cara Lubner, medforfattere af papiret “Mechanistic Insights into Energy Conservation by Flavin-Based Electron Bifurcation, ”Stå ved siden af en laser kombineret med et spe
Ny metode til mikrobiel energiproduktion opdagetPaul King, David Mulder og Cara Lubner, medforfattere af papiret “Mechanistic Insights into Energy Conservation by Flavin-Based Electron Bifurcation, ”Stå ved siden af en laser kombineret med et spe -
 Reaktion tilføjer chirale grupper til nitrogenringe uden først at installere reaktive grupperKredit:CC0 Public Domain En trio af forskere ved University of Cambridge har fundet på en ny måde at kontrollere tilføjelsen af chiralitet til nitrogenringe uden først at installere reaktive gru
Reaktion tilføjer chirale grupper til nitrogenringe uden først at installere reaktive grupperKredit:CC0 Public Domain En trio af forskere ved University of Cambridge har fundet på en ny måde at kontrollere tilføjelsen af chiralitet til nitrogenringe uden først at installere reaktive gru
- Er fosforsyre ætsende eller ikke ætsende?
- Hvad er rummet omkring et ladet objekt, hvor en anden oplever en elektrisk kraft?
- Hvad er en enhed, der omdanner elektrisk energi til bevægelse eller mekanisk bevægelse?
- En høj-indhold triethylphosphat-baseret, ikke-brændbar og høj ledningsevne elektrolyt til lithium…
- Forsker bruger lynstorme til at måle tætheden af Jordens øvre atmosfære
- Air France-KLM udnævner midlertidige ledere efter administrerende direktørers hurtige exit


