Hvad er Lewis -strukturen for carbonylfluorid?
1. Tæl valenselektroner
* Carbon (C):4 Valenselektroner
* Oxygen (O):6 Valenselektroner
* Fluor (F):7 Valenselektroner hver (2 fluoratomer =14 elektroner)
Samlede valenselektroner =4 + 6 + 14 =24
2. Bestem det centrale atom
* Carbon er det mindst elektronegative atom, hvilket gør det til det centrale atom.
3. Forbind atomer med enkeltbindinger
* Tilslut carbonatomet til ilt og to fluoratomer med enkeltbindinger. Dette bruger 6 valenselektroner (3 bindinger x 2 elektroner/binding).
4. Distribuer resterende elektroner
* Du har 18 valenselektroner tilbage (24 i alt - 6 brugt).
* Fuldfør octets af de ydre atomer (ilt og fluor) ved at tilføje ensomme par. Oxygen har brug for to ensomme par (4 elektroner), og hver fluor har brug for tre ensomme par (6 elektroner hver). Dette bruger 16 elektroner (4 + 6 + 6).
5. Kontroller for Octet regel tilfredshed
* Carbon har i øjeblikket kun 6 elektroner omkring det. For at tilfredsstille oktetreglen skal du flytte et ensomt par fra ilt for at danne en dobbeltbinding mellem kulstof og ilt.
6. Endelig Lewis -struktur
Den sidste Lewis -struktur til carbonylfluor ser sådan ud:
O
||
C - f
|
F
Nøglepunkter:
* Carbonatomet har en dobbeltbinding med ilt og enkeltbindinger med hvert fluoratom.
* Oxygen har to ensomme par.
* Hvert fluoratom har tre ensomme par.
* Alle atomer tilfredsstiller oktetreglen (undtagen brint, som kun har brug for 2 elektroner).
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvad er den kemiske formel for cesiumhybromit?
Næste artikelKan svovl udføre elektricitet som et fast stof?
 Varme artikler
Varme artikler
-
 Forbløffende effekt muliggør bedre palladiumkatalysatorerSe ind i ultrahøjvakuumkammeret (katalysatorprøve i midten). Kredit:Vienna University of Technology I kemi, atomer kan normalt kun påvirke deres umiddelbare naboskab. På TU Wien, en ny effekt med
Forbløffende effekt muliggør bedre palladiumkatalysatorerSe ind i ultrahøjvakuumkammeret (katalysatorprøve i midten). Kredit:Vienna University of Technology I kemi, atomer kan normalt kun påvirke deres umiddelbare naboskab. På TU Wien, en ny effekt med -
 En ny metode til installation af svovl i komplekse molekylerForskere, der arbejder i laboratoriet i Ben Shen, Ph.d., hos Scripps Research, Florida har fundet en ny familie af svovlinstallerende enzymer ved at udvinde bakteriernes genomer i deres samling af mik
En ny metode til installation af svovl i komplekse molekylerForskere, der arbejder i laboratoriet i Ben Shen, Ph.d., hos Scripps Research, Florida har fundet en ny familie af svovlinstallerende enzymer ved at udvinde bakteriernes genomer i deres samling af mik -
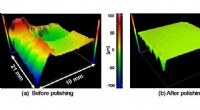 Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el
Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el -
 Sjældne jordarters orthoferrit LnFeO3 nanopartikler til bioimagingKredit:Wiley Magnetisk resonansbilleddannelse (MRI) har vist sig som et af de mest kraftfulde kliniske billeddannelsesværktøjer på grund af dens fremragende rumlige opløsning og bløddelskontrast,
Sjældne jordarters orthoferrit LnFeO3 nanopartikler til bioimagingKredit:Wiley Magnetisk resonansbilleddannelse (MRI) har vist sig som et af de mest kraftfulde kliniske billeddannelsesværktøjer på grund af dens fremragende rumlige opløsning og bløddelskontrast,
- Træer kan hjælpe med at reducere ammoniakemissioner fra landbruget
- Hvad er loppe ecto parasit?
- Flip-flop qubits:Radikalt nyt kvanteberegningsdesign opfundet
- Omkostningseffektive måder at minimere risici i forsyningskæden
- Billede:Rummænd på arbejde
- Hvilket udtryk betyder nyttige materialer, der findes i naturen?


