Hvorfor findes der hydrogenioner af sig selv?
* opladning: Hydrogenioner har en enkelt positiv ladning. Dette gør dem meget reaktive og tilbøjelige til at danne bindinger med andre molekyler eller ioner for at opnå stabilitet.
* solvation: I vand interagerer hydrogenioner stærkt med vandmolekyler. Den positive ladning af H+ tiltrækker den negative ende af vandmolekylet (iltatomet), der danner en struktur kaldet A hydroniumion (H3O+) . Denne interaktion er så stærk, at det i det væsentlige er umuligt for H+ at eksistere uafhængigt i en vandig løsning.
* sur karakter: Dannelsen af hydroniumioner er det, der gør opløsninger sure. Koncentrationen af hydroniumioner bestemmer direkte surhedsgraden af en opløsning.
Kortfattet: Hydrogenioner er meget reaktive og forbinder altid med andre molekyler eller ioner, som vandmolekyler, for at danne stabile arter. Mens vi ofte bruger symbolet H+ til at repræsentere surhedsgraden af en opløsning, er det vigtigt at huske, at det faktisk er hydroniumionen (H3O+), der findes i opløsning.
 Varme artikler
Varme artikler
-
 Kulstofaffald fra stålproduktion kan genanvendes til nye produkterFigur 1:At vide, hvordan en nikkeljernsulfidkatalysator hjælper med at reducere kuldioxid til kulilte og andre kulbaserede produkter, kan føre til teknologier, der kan omdanne kuldioxid i atmosfæren t
Kulstofaffald fra stålproduktion kan genanvendes til nye produkterFigur 1:At vide, hvordan en nikkeljernsulfidkatalysator hjælper med at reducere kuldioxid til kulilte og andre kulbaserede produkter, kan føre til teknologier, der kan omdanne kuldioxid i atmosfæren t -
 Mod forbedret sårheling:Kemisk syntese af et trefoil faktor peptidUndersøgelser viste, at trefoil-faktor-peptider produceres lokalt for at bekæmpe inflammation og skader i mave-tarmkanalen ved at fremskynde sårheling. Kredit:Universität Wien Den fascinerende fam
Mod forbedret sårheling:Kemisk syntese af et trefoil faktor peptidUndersøgelser viste, at trefoil-faktor-peptider produceres lokalt for at bekæmpe inflammation og skader i mave-tarmkanalen ved at fremskynde sårheling. Kredit:Universität Wien Den fascinerende fam -
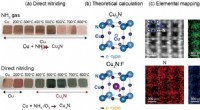 Højtydende nitrid-halvleder til miljøvenlig solcelle(a) Dette er et kobber- og kobbernitrid. (b) Teoretisk beregning for P-type og N-type kobbernitrid. (c) Direkte observation af fluorposition i fluordoteret kobbernitrid.(a) Et billede af tyndfilms kob
Højtydende nitrid-halvleder til miljøvenlig solcelle(a) Dette er et kobber- og kobbernitrid. (b) Teoretisk beregning for P-type og N-type kobbernitrid. (c) Direkte observation af fluorposition i fluordoteret kobbernitrid.(a) Et billede af tyndfilms kob -
 Bakteriefabrikker bruges til at opdage potentielle nye malariamedicinDerivater af violacein. Kredit:Hung-En Lai Forskere har konstrueret bakterier til at producere nye versioner af et potentielt antibiotisk molekyle, nogle med kraftige antimalariaegenskaber. Brug
Bakteriefabrikker bruges til at opdage potentielle nye malariamedicinDerivater af violacein. Kredit:Hung-En Lai Forskere har konstrueret bakterier til at producere nye versioner af et potentielt antibiotisk molekyle, nogle med kraftige antimalariaegenskaber. Brug
- Ny forskning afslører effekten af global opvarmning på issmeltning i Grønland
- Hvordan dannes geotermiske puljer?
- Hvorfor er Madagaskars berømte lemurer ikke blevet reddet endnu?
- Tidlig opdagelse af ozon på jordoverfladen kan hjælpe med at forhindre skader på druer og æbler
- Hvem høster Suns Energy og producerer mad?
- Hvor mange pund i 1900 gram?


