I elektrolyse af fortyndet sølvchlorid, hvad udledes ved katoden?
* elektrolyse: Elektrolyse er processen med at bruge en elektrisk strøm til at drive en ikke-spontan kemisk reaktion.
* katode: Katoden er den negativt ladede elektrode i en elektrolytisk celle.
* decharge: Ved katoden tiltrækkes positivt ladede ioner (kationer) og får elektroner og bliver neutrale atomer eller molekyler.
I en fortyndet sølvchloridopløsning forekommer følgende:
1. sølvchlorid (AGCL) opløses lidt: Nogle AgCl opløses til dannelse af sølvioner (Ag+) og chloridioner (Cl-).
2. hydrogenioner (H+) er også til stede: Da opløsningen er fortyndet, vil vandmolekyler også adskille sig i lille grad og producere brintioner (H+).
3. katode: Ved katoden tiltrækkes både Ag+ og H+. Sølv har imidlertid et højere reduktionspotentiale end brint. Dette betyder, at sølvioner lettere reduceres end brintioner.
4. sølvaflejring: Ag+ -ionerne får elektroner ved katoden og reduceres til metallisk sølv (Ag), der afsættes på katodeoverfladen.
reaktion ved katoden:
AG + + E- → AG (S)
Derfor er sølv det primære produkt, der udledes ved katoden under elektrolysen af fortyndet sølvchloridopløsning.
 Varme artikler
Varme artikler
-
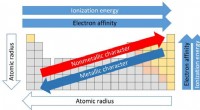 Forståelse af det periodiske system gennem linsen af de flygtige gruppe I metallerTendenser i det periodiske system. Kredit:Sandbh/Wikipedia, CC BY-SA Nyheden brød ud, at en jernbanevogn, fyldt med rent natrium, var lige afsporet og spildte dens indhold. En tv-reporter ringede
Forståelse af det periodiske system gennem linsen af de flygtige gruppe I metallerTendenser i det periodiske system. Kredit:Sandbh/Wikipedia, CC BY-SA Nyheden brød ud, at en jernbanevogn, fyldt med rent natrium, var lige afsporet og spildte dens indhold. En tv-reporter ringede -
 En klar halvleder baseret på tin kunne forbedre solenergiproduktionenRåmaterialet, der bruges til at fremstille tindioxid-halvledere. Kredit:© 2020 Nakao et al. Mobilitet er en nøgleparameter for halvlederydelse og relaterer sig til, hvor hurtigt og nemt elektroner
En klar halvleder baseret på tin kunne forbedre solenergiproduktionenRåmaterialet, der bruges til at fremstille tindioxid-halvledere. Kredit:© 2020 Nakao et al. Mobilitet er en nøgleparameter for halvlederydelse og relaterer sig til, hvor hurtigt og nemt elektroner -
 Billig teknik til ætsning af nanohuller i silicium kunne understøtte ny filtrering og nanofotonisk…Et eksempel på retningsetsning for nanohole -arrays på mindre end 500 nm i diameter. Kredit:© 2017 A*STAR Institute of Materials Research and Engineering Metalassisteret kemisk ætsning, eller MacE
Billig teknik til ætsning af nanohuller i silicium kunne understøtte ny filtrering og nanofotonisk…Et eksempel på retningsetsning for nanohole -arrays på mindre end 500 nm i diameter. Kredit:© 2017 A*STAR Institute of Materials Research and Engineering Metalassisteret kemisk ætsning, eller MacE -
 Omdannelse af kuldioxid til butanol ved hjælp af phosphorrige kobberkatoderForskere fra Gwangju Institute of Science and Technology udviklede en metode til direkte at generere 1-butanol, en alternativ brændstofkilde, fra CO 2 ved brug af kobberphosphidelektroder. Kredit:Gw
Omdannelse af kuldioxid til butanol ved hjælp af phosphorrige kobberkatoderForskere fra Gwangju Institute of Science and Technology udviklede en metode til direkte at generere 1-butanol, en alternativ brændstofkilde, fra CO 2 ved brug af kobberphosphidelektroder. Kredit:Gw
- Hawaii -forskere holdt dataene flydende under kriserespons på Kīlauea
- Hvordan beregner du lufthastigheden i en mine?
- De længste genstande, som Visble på himlen kaldes?
- Efterforskning af radiologisk kriminalitet:Videnskabsdetektiver satte sig selv på prøve
- Fiberoptisk sensor måler små magnetiske felter
- Hvad indikerer tilstedeværelsen af molekylære bånd i spektrum en stjerne?


