Hvilken er en stabil forbindelse srcl alf2 bas?
* ioniske forbindelser: De anførte forbindelser er alle ioniske forbindelser, hvilket betyder, at de dannes af den elektrostatiske tiltrækning mellem positivt ladede ioner (kationer) og negativt ladede ioner (ANION'er).
* forudsigelse af stabilitet: Stabiliteten af ioniske forbindelser påvirkes generelt af følgende faktorer:
* Elektrostatisk attraktion: Stærkere elektrostatiske attraktioner mellem ioner fører til mere stabile forbindelser. Dette er relateret til anklagerne for ionerne og deres størrelse.
* gitterenergi: Dette er et mål for den frigivne energi, når ioner mødes for at danne en krystalgitter. Højere gitterenergi indikerer generelt en mere stabil forbindelse.
* analyse af forbindelserne:
* srcl: Strontium (SR) er i gruppe 2 og danner en +2 ion (SR²⁺). Chlor (CL) er i gruppe 17 og danner en -1 -ion (Cl⁻). Formlen for strontiumchlorid er srcl₂ , ikke srcl. Denne forbindelse er stabil.
* alf₂: Aluminium (AL) er i gruppe 13 og danner en +3 ion (al³⁺). Fluor (F) er i gruppe 17 og danner en -1 -ion (F⁻). Formlen for aluminiumfluorid er alf₃ , ikke alf₂. Denne forbindelse er også stabil.
* bas: Barium (BA) er i gruppe 2 og danner en +2 ion (Ba²⁺). Svovl (er) er i gruppe 16 og danner en -2 ion (s²⁻). Denne formel er korrekt, og denne forbindelse er stabil.
Konklusion:
* srcl₂ (strontiumchlorid)
* alf₃ (aluminiumfluorid)
* bas (bariumsulfid)
Alle tre af disse forbindelser er stabile. Husk at altid tjekke formlerne baseret på anklagerne for de involverede ioner.
Sidste artikelHvad er produktet af CO2 H2O?
Næste artikelHvad er det stadie, hvor nuklear materiale opdeler og adskiller sig?
 Varme artikler
Varme artikler
-
 De kemiske hemmeligheder bag vanilje lokkerKredit:CC0 Public Domain Fra is til lattes er vanilje et af de mest populære krydderier i verden. Det er også en af de mest arbejdskrævende at producere, og genveje fører til et mindre velsmagend
De kemiske hemmeligheder bag vanilje lokkerKredit:CC0 Public Domain Fra is til lattes er vanilje et af de mest populære krydderier i verden. Det er også en af de mest arbejdskrævende at producere, og genveje fører til et mindre velsmagend -
 En havændring for plastikforurening:nyt materiale nedbrydes biologisk i havvandEn bæredygtig Blueview-sko nedbrydes biologisk i havvand efter 11 uger. Kredit:Daniel Zhen, Algenesis Inc. Plast, der nu er allestedsnærværende i den moderne verden, er blevet en stigende trussel m
En havændring for plastikforurening:nyt materiale nedbrydes biologisk i havvandEn bæredygtig Blueview-sko nedbrydes biologisk i havvand efter 11 uger. Kredit:Daniel Zhen, Algenesis Inc. Plast, der nu er allestedsnærværende i den moderne verden, er blevet en stigende trussel m -
 RES URBIS-projektet viser levedygtigheden af bioplastproduktion med bioaffald fra byerEn prøve af det brugte affald, det taget produkt fra bakterievirkning, samt flere indhentede bioplastprodukter i projektet. Kredit:J. Mata/UB I en cirkulær økonomi, byaffald bliver omdannet til re
RES URBIS-projektet viser levedygtigheden af bioplastproduktion med bioaffald fra byerEn prøve af det brugte affald, det taget produkt fra bakterievirkning, samt flere indhentede bioplastprodukter i projektet. Kredit:J. Mata/UB I en cirkulær økonomi, byaffald bliver omdannet til re -
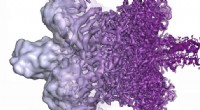 Livet frosset i tid under et elektronmikroskop får en nobelprisElektronmikroskopets opløsning er radikalt forbedret i de sidste par år, fra for det meste at vise formløse klatter (venstre) i 2013 til nu at kunne visualisere proteiner ved atomopløsning (til højre)
Livet frosset i tid under et elektronmikroskop får en nobelprisElektronmikroskopets opløsning er radikalt forbedret i de sidste par år, fra for det meste at vise formløse klatter (venstre) i 2013 til nu at kunne visualisere proteiner ved atomopløsning (til højre)


