Hvorfor er HF surt?
HF er et polært molekyle på grund af den betydelige forskel i elektronegativitet mellem brint (2,1) og fluor (4,0). Denne polaritet resulterer i en delvis positiv ladning på hydrogenatomet og en delvis negativ ladning på fluoratomet. Det elektronegative fluoratom tiltrækker elektroner mod sig selv, hvilket skaber en stærk polær binding.
2. Høj bindingsdissociationsenergi:
HF-bindingen i HF har en høj bindingsdissociationsenergi på 565 kJ/mol. Det betyder, at der kræves en betydelig mængde energi for at bryde bindingen og adskille brint- og fluoratomerne. Den høje bindingsdissociationsenergi bidrager til stabiliteten af HF og gør den mindre tilbøjelig til at dissociere til H+ og F-ioner i vand.
3. Lille størrelse af fluoridionen:
Fluoridionen (F-) er meget lille i størrelse på grund af dens høje elektronegativitet, som gør det muligt for den at holde sine elektroner tæt. Den lille størrelse af fluoridionen resulterer i en høj ladningstæthed, hvilket gør den til en stærk base. Dette betyder, at F-ioner ikke er særlig effektive til at stabilisere H+-ioner i vand, hvilket fører til dissociation af HF og frigivelse af H+-ioner.
4. Hydrogenbinding:
HF-molekyler kan deltage i hydrogenbinding med vandmolekyler. Hydrogenbinding involverer dannelsen af intermolekylære bindinger mellem et brintatom, der er kovalent bundet til et meget elektronegativt atom (såsom F) og et andet elektronegativt atom (såsom O). Disse hydrogenbindinger hjælper med at stabilisere HF-molekylerne og øger HF-syrens surhedsgrad yderligere.
Sammenfattende kan surhedsgraden af HF tilskrives polariteten af H-F-bindingen, den høje bindingsdissociationsenergi, den lille størrelse af fluoridionen og HF's evne til at deltage i hydrogenbinding. Disse faktorer bidrager tilsammen til den delvise ionisering af HF i vand, hvilket resulterer i frigivelse af H+ ioner og gør HF til en sur forbindelse.
Sidste artikelHvad er pH-værdien af en 0,5 M HF-opløsning?
Næste artikelHvilken type syreeddike indeholder?
 Varme artikler
Varme artikler
-
 Forskere præsenterer indsigt i søgen efter nye antibiotikaKredit:University of Oklahoma Et samarbejdende forskerhold fra University of Oklahoma, Memorial Sloan Kettering Cancer Center og Merck &Co. offentliggjorde en meningsartikel i tidsskriftet, Natur
Forskere præsenterer indsigt i søgen efter nye antibiotikaKredit:University of Oklahoma Et samarbejdende forskerhold fra University of Oklahoma, Memorial Sloan Kettering Cancer Center og Merck &Co. offentliggjorde en meningsartikel i tidsskriftet, Natur -
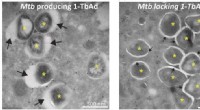 Antacida hjælper tuberkulosebakterier med at overleveElektronmikroskopibilleder, der viser bakterierne (*) der producerer 1-TbAd er omgivet af et hævet fagosom (store pile, venstre billede) og bakterier, der ikke producerer 1-TbAd, er omgivet af stramme
Antacida hjælper tuberkulosebakterier med at overleveElektronmikroskopibilleder, der viser bakterierne (*) der producerer 1-TbAd er omgivet af et hævet fagosom (store pile, venstre billede) og bakterier, der ikke producerer 1-TbAd, er omgivet af stramme -
 Forskere udvikler den første funktionelle ikke-native metalhydrogenaseKredit:CC0 Public Domain Hydrogenaser er enzymer, der katalyserer hydrogenaktivering. Der er tre typer hydrogenaser i naturen, alle indeholder jern og nogle af dem nikkel. Men i syntetisk kemi er
Forskere udvikler den første funktionelle ikke-native metalhydrogenaseKredit:CC0 Public Domain Hydrogenaser er enzymer, der katalyserer hydrogenaktivering. Der er tre typer hydrogenaser i naturen, alle indeholder jern og nogle af dem nikkel. Men i syntetisk kemi er -
 Tilpasning af partikelstørrelserne af Pt₅Ce-legering nanopartikler til oxygenreduktionsreaktionenIfølge forskellige mekanismer for partikelvæksten er synteseprocessen opdelt i tre sekventielle perioder, nemlig periode 1, hvor Pt4+ ioner reduceres til Pt-nanopartikler; Periode 2, hvor Pt-nanoparti
Tilpasning af partikelstørrelserne af Pt₅Ce-legering nanopartikler til oxygenreduktionsreaktionenIfølge forskellige mekanismer for partikelvæksten er synteseprocessen opdelt i tre sekventielle perioder, nemlig periode 1, hvor Pt4+ ioner reduceres til Pt-nanopartikler; Periode 2, hvor Pt-nanoparti
- Forsker ser fremtiden for hør og hamp som spånpladealternativ
- Hvad er det videnskabelige sikkerhedssymbol for aldrig at smage eller lugte et ukendt stof?
- Primater vs kobraer:Hvordan vores sidste fælles forfader byggede giftmodstand
- Hvad er deformation i jordens videnskab?
- De hurtigst voksende planter for videnskabseksperimenter
- Lader de blade hobe sig op? Ny forskning viser, at bladaffald indeholder vedvarende frie radikaler


