Hvorfor er kogepunktet for NaCl højere end saccharose?
1. Ionisk binding vs. kovalent binding:
* NaCl: Natriumchlorid er en ionisk forbindelse. Dens struktur består af en stærk elektrostatisk attraktion mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-). Disse ioniske bindinger er meget stærke og kræver en stor mængde energi for at bryde.
* saccharose: Sucrose er en kovalent forbindelse. Det holdes sammen af kovalente bindinger, der involverer deling af elektroner mellem atomer. Mens disse bindinger er stærke, er de svagere end ioniske bindinger.
2. Intermolekylære kræfter:
* NaCl: På grund af de stærke ioniske bindinger udviser NaCl stærke elektrostatiske interaktioner mellem ioner, selv i den flydende tilstand. Disse interaktioner kaldes ion-dipolkræfter og er ansvarlige for det høje kogepunkt.
* saccharose: Sucrosemolekyler er polære, hvilket betyder, at de har en let adskillelse af ladning. De interagerer via svagere intermolekylære kræfter kaldet hydrogenbinding og dipol-dipol-interaktioner. Disse kræfter er meget svagere end ioniske kræfter.
3. Gitter Energi:
* NaCl: Krystallgitteret i NaCl har en meget høj gitterenergi, hvilket betyder, at det kræver en masse energi for at bryde de ioniske bindinger og smelte det faste stof. Denne høje gitterenergi bidrager til dets høje kogepunkt.
* saccharose: Sucrose har en lavere gitterenergi på grund af sine svagere kovalente bindinger.
Kortfattet:
De stærkere ioniske bindinger og de resulterende stærke intermolekylære kræfter i NaCI kræver en meget højere temperatur for at overvinde og få stoffet til at koge sammenlignet med saccharose med dets svagere kovalente bindinger og svagere intermolekylære kræfter.
 Varme artikler
Varme artikler
-
 Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil
Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil -
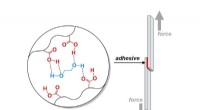 Hvordan laver man klæbemidler til elektronik, køretøjer, og konstruktion hårdere?Et Purdue University-team tilføjede bindinger, der let brydes i hele materialet for at styrke klæbemidlet. Kredit:Jonathan Wilker/Purdue University Gør dem hårdere ved at gøre dem svagere. Det er
Hvordan laver man klæbemidler til elektronik, køretøjer, og konstruktion hårdere?Et Purdue University-team tilføjede bindinger, der let brydes i hele materialet for at styrke klæbemidlet. Kredit:Jonathan Wilker/Purdue University Gør dem hårdere ved at gøre dem svagere. Det er -
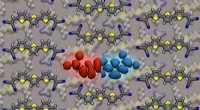 Tuning the energy gap:En ny tilgang til organiske halvledereVarierende forholdet mellem 3T -molekyler (forgrund) og 6T -molekyler (angivet i baggrunden) i blandingen gør det muligt at afstemme hullet kontinuerligt. Kredit:Sebastian Hutsch, Frank Ortmann Tu
Tuning the energy gap:En ny tilgang til organiske halvledereVarierende forholdet mellem 3T -molekyler (forgrund) og 6T -molekyler (angivet i baggrunden) i blandingen gør det muligt at afstemme hullet kontinuerligt. Kredit:Sebastian Hutsch, Frank Ortmann Tu -
 Det er sejt! Flash-frosne billeder afslører molekylær verdenLille er smuk:Den schweiziske videnskabsmand Jacques Dubochet giver tommelfingeren op efter at være blevet udpeget som en af tre vindere af dette års Nobelpris i kemi, præmieret for deres arbejde me
Det er sejt! Flash-frosne billeder afslører molekylær verdenLille er smuk:Den schweiziske videnskabsmand Jacques Dubochet giver tommelfingeren op efter at være blevet udpeget som en af tre vindere af dette års Nobelpris i kemi, præmieret for deres arbejde me
- Hvis 400 j varme føjes til en gas i en isokorisk proces -komma, hvad er ændringen af dens intern…
- Hvilke 2 måder får en hastighed til at ændre sig?
- Stop med at fortælle eleverne om at studere STEM i stedet for humaniora for post-coronavirus-verden…
- Synlige hydrogeler til hurtig blødningskontrol og overvågning
- Mars overflade mere ubeboelig end troet:undersøgelse
- Sådan fungerer oprydning på gerningssted


