Hvad er Lewis Dot -strukturen i NO2 -kationisk ligand?
1. Tæl det samlede antal valenselektroner:
* Nitrogen (N) har 5 valenselektroner.
* Oxygen (O) har 6 valenselektroner hver, hvilket giver 12 i alt.
* Den positive afgift indikerer et tab af en elektron, så træk 1.
* Samlede valenselektroner:5 + 12 - 1 =16
2. Bestem det centrale atom:
* Nitrogen er mindre elektronegativ end ilt, så det vil være det centrale atom.
3. Arranger atomerne:
* Placer nitrogenatomet i midten og de to iltatomer omkring det.
4. Tilslut atomerne med enkeltbindinger:
* Tegn en enkelt binding (en linje) mellem nitrogenet og hvert iltatom. Dette bruger 4 valenselektroner.
5. Distribuer de resterende valenselektroner som ensomme par:
* Du har 12 valenselektroner tilbage (16 - 4).
* For at tilfredsstille oktetreglen for ilt skal du placere tre ensomme par (6 elektroner) omkring hvert iltatom.
6. Kontroller de formelle afgifter:
* Nitrogen:5 (Valenselektroner) - 4 (ikke -bindende elektroner) - 4 (binding af elektroner) =-3
* Oxygen:6 (Valenselektroner) - 6 (ikke -bindende elektroner) - 2 (binding af elektroner) =-2
* Den samlede formelle ladning skal svare til den samlede ladning af molekylet, som er +1.
* For at opnå dette skal du flytte et ensomt par fra et af iltatomerne for at danne en dobbeltbinding med nitrogenet.
7. Final Lewis Dot Structure:
Den sidste Lewis Dot -struktur af NO2+ ser sådan ud:
`` `
O
||
N
/ \
O o
`` `
Nøglepunkter:
* Nitrogen har en formel afgift på +1.
* Et ilt har en formel afgift på 0.
* Det andet ilt har en formel afgift på 0.
Fortæl mig, hvis du har nogen andre Lewis Dot Structure -spørgsmål!
 Varme artikler
Varme artikler
-
 Forskere forbereder nyt lavtsmeltende, nitrogenholdigt, stannochlorophosphatglasSn-P-O-Cl-N glas fremstillet ved forskellige temperaturer. Kredit:SIOM Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) har forberedt et
Forskere forbereder nyt lavtsmeltende, nitrogenholdigt, stannochlorophosphatglasSn-P-O-Cl-N glas fremstillet ved forskellige temperaturer. Kredit:SIOM Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) har forberedt et -
 Formskiftende materialer:Brug af lys til at omarrangere makroskopiske strukturerTEM-billeder af selvsamlende nanostrukturer og deres rekombinationer, i falske farver. Kredit:Okinawa Institute of Science and Technology Graduate University - OIST OIST-forskere skaber selvsamlen
Formskiftende materialer:Brug af lys til at omarrangere makroskopiske strukturerTEM-billeder af selvsamlende nanostrukturer og deres rekombinationer, i falske farver. Kredit:Okinawa Institute of Science and Technology Graduate University - OIST OIST-forskere skaber selvsamlen -
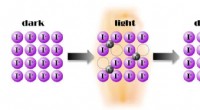 Lysstyret strømtransport med ladede atomer demonstreret for første gangEn tidligere ukendt fotoeffekt:i nogle materialer, såsom i perovskit methylammonium blyiodid (MAPI), ioner bidrager meget stærkt til lysinduceret ledningsevne. Som sædvanligt i solceller, lyset frigiv
Lysstyret strømtransport med ladede atomer demonstreret for første gangEn tidligere ukendt fotoeffekt:i nogle materialer, såsom i perovskit methylammonium blyiodid (MAPI), ioner bidrager meget stærkt til lysinduceret ledningsevne. Som sædvanligt i solceller, lyset frigiv -
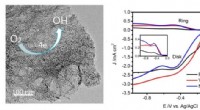 Ny elektrokatalysator udviklet til iltreduktionsreaktionVanadiumnitrid kvanteprikker forankret homogent på nitrogen-doteret grafen (VNQD-NG) blev fremstillet. De unikke strukturelle træk ved VNQD-NG inklusive de rigelige VN-kvantepunkter, højt overfladeare
Ny elektrokatalysator udviklet til iltreduktionsreaktionVanadiumnitrid kvanteprikker forankret homogent på nitrogen-doteret grafen (VNQD-NG) blev fremstillet. De unikke strukturelle træk ved VNQD-NG inklusive de rigelige VN-kvantepunkter, højt overfladeare
- Global opvarmning øger risikoen for frostskader på træer
- Hvad er den kraft, som et bevægende objekt har, som er afhængig af hastighed og vægt af IS?
- Hvilke produkter fremstilles, når kulbrinter brænder?
- Delikat åbning af et båndgab i grafen muliggør højtydende transistorer
- Dark Energy Camera fanger rester af en massiv stjerne, der eksploderede for næsten 11.000 år siden…
- Vil du sige dit job op eller overvejer at tiltræde den store opsigelse? Her er hvad en ansættelses…


