Giv elektronkonfigurationen til et neutralt atom af klor?
1S² 2S² 2P⁶ 3S² 3P⁵
Sådan forstår du det:
* 1S²: Det første energiniveau (n =1) har en underskal (er), der kan indeholde 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har ens underskal, der kan indeholde 2 elektroner.
* 2p⁶: Det andet energiniveau har også et P -underskal, der kan indeholde 6 elektroner.
* 3S²: Det tredje energiniveau (n =3) har ens underskal, der kan indeholde 2 elektroner.
* 3p⁵: Det tredje energiniveau har også et P -underskal, der kun delvist er fyldt med 5 elektroner (det kan indeholde 6).
Denne konfiguration viser arrangementet af chlorens 17 elektroner i deres respektive energiniveau og underskaller.
Sidste artikelSkriv den elektroniske konfiguration af klor?
Næste artikelHvilken masse natriumchlorid indeholder 4,59 EXP24 -formelenheder?
 Varme artikler
Varme artikler
-
 Kemiske forbindelser i fødevarer kan hæmme et centralt SARS-CoV-2-enzymKemiske forbindelser i muscadinedruer hæmmer effektivt en vigtig SARS-CoV-2-protease. Kredit:De-Yu Xie, NC State University Kemiske forbindelser i fødevarer eller drikkevarer som grøn te, muscadin
Kemiske forbindelser i fødevarer kan hæmme et centralt SARS-CoV-2-enzymKemiske forbindelser i muscadinedruer hæmmer effektivt en vigtig SARS-CoV-2-protease. Kredit:De-Yu Xie, NC State University Kemiske forbindelser i fødevarer eller drikkevarer som grøn te, muscadin -
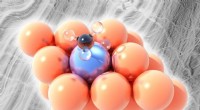 Omdannelse af gas til brændstoffer med bedre legeringerAfbildet, platin-kobber enkeltatom legeringen. Kobber (orange) er ude af stand til at bryde bindinger mellem kulstof (sort) og brint (klart) i metanderivater undtagen ved højere temperaturer, men et e
Omdannelse af gas til brændstoffer med bedre legeringerAfbildet, platin-kobber enkeltatom legeringen. Kobber (orange) er ude af stand til at bryde bindinger mellem kulstof (sort) og brint (klart) i metanderivater undtagen ved højere temperaturer, men et e -
 Fysikere udvikler ideelle testbetingelser for solceller til rumapplikationerUniversity of Oklahoma kandidatstuderende, Sergio Chacon, hjælper bachelor-forsker Rachel Penner med at opsætte perovskit-solcellemålinger. Kredit:Ian Sellers, University of Oklahoma. Forskere ved
Fysikere udvikler ideelle testbetingelser for solceller til rumapplikationerUniversity of Oklahoma kandidatstuderende, Sergio Chacon, hjælper bachelor-forsker Rachel Penner med at opsætte perovskit-solcellemålinger. Kredit:Ian Sellers, University of Oklahoma. Forskere ved -
 For fotokatalysatorer, at klare tidens tand betyder at finde en perfekt partnerKredit:Pixabay/CC0 Public Domain Nøglen til effektivt at høste energi fra sollys kunne være at finde de rigtige kombinationer af lysfangende materialer. Forskere ved KAUST har opdaget, at en form
For fotokatalysatorer, at klare tidens tand betyder at finde en perfekt partnerKredit:Pixabay/CC0 Public Domain Nøglen til effektivt at høste energi fra sollys kunne være at finde de rigtige kombinationer af lysfangende materialer. Forskere ved KAUST har opdaget, at en form
- Materialer kan forsinke frost op til 300 gange længere tid end eksisterende belægninger mod isdann…
- Sådan begrænser du den globale opvarmning til 1,5C
- Materialer, der tillader gebyrerne for en elektrisk strøm at bevæge sig frit gennem dem, kaldes hv…
- Hvad er krafttidsgrafen for et accelererende objekt?
- Hvorfor er det mørkt udenfor?
- Hvem udviklede sig Hvad er forholdet mellem masse og energi?


