Skriv den elektroniske konfiguration af klor?
1S² 2S² 2P⁶ 3S² 3P⁵
Sådan forstår du dette:
* 1S²: Det første energiniveau (n =1) har 1 underskal (er), som kan indeholde 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har 1 underskal (er), som kan indeholde 2 elektroner.
* 2p⁶: Det andet energiniveau (n =2) har også 3 underskaller (P), som kan indeholde i alt 6 elektroner (2 elektroner pr. P -underskaller).
* 3S²: Det tredje energiniveau (n =3) har 1 underskal (er), som kan indeholde 2 elektroner.
* 3p⁵: Det tredje energiniveau (n =3) har også 3 underskaller (P), der indeholder 5 elektroner.
Vigtig note: Klor har 17 elektroner, og den elektroniske konfiguration afspejler dette.
Sidste artikelHvad er den relative formelmasse af jernsulfat?
Næste artikelGiv elektronkonfigurationen til et neutralt atom af klor?
 Varme artikler
Varme artikler
-
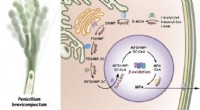 Mysteriet om immunsuppressive lægemidler biosyntese blev endelig låst opKompartmentaliseret biosyntese af mycophenolsyre. Kredit:ZHANG Wei og LI Shengying Mycophenolsyre (MPA), opdaget i 1893, var det første naturlige antibiotikum, der blev isoleret og krystalliseret
Mysteriet om immunsuppressive lægemidler biosyntese blev endelig låst opKompartmentaliseret biosyntese af mycophenolsyre. Kredit:ZHANG Wei og LI Shengying Mycophenolsyre (MPA), opdaget i 1893, var det første naturlige antibiotikum, der blev isoleret og krystalliseret -
 Forskere bliver ru med nanomaterialer for at eliminere problematisk klæbrighed forårsaget af glatt…Øverste billede (fra venstre mod højre):Undergraduate Katerina Kimes (siddende), Professor Tevis Jacobs, Bachelorstuderende Cameron Kisailus, og ph.d. Kandidat Abhijeet Gujrati ser på et kort over ove
Forskere bliver ru med nanomaterialer for at eliminere problematisk klæbrighed forårsaget af glatt…Øverste billede (fra venstre mod højre):Undergraduate Katerina Kimes (siddende), Professor Tevis Jacobs, Bachelorstuderende Cameron Kisailus, og ph.d. Kandidat Abhijeet Gujrati ser på et kort over ove -
 Moderne porøst materiale ligner XIV Century Alhambra mosaikKredit:Imdea Forskere fra Spanien og USA har syntetiseret en hidtil uset metal-organisk ramme (MOF), der indeholder en perfekt lineær brokæde, der viser en smuk lighed med en islamisk mosaik fra d
Moderne porøst materiale ligner XIV Century Alhambra mosaikKredit:Imdea Forskere fra Spanien og USA har syntetiseret en hidtil uset metal-organisk ramme (MOF), der indeholder en perfekt lineær brokæde, der viser en smuk lighed med en islamisk mosaik fra d -
 Ny grænse for 3D-printning udvikler avancerede bløde materialer, der er i stand til at helbrede si…Kredit:CC0 Public Domain Det videnskabelige samfund fokuserer sin forskning på de mange anvendelser af hydrogeler, polymere materialer, der indeholder en stor mængde vand, som har potentialet til
Ny grænse for 3D-printning udvikler avancerede bløde materialer, der er i stand til at helbrede si…Kredit:CC0 Public Domain Det videnskabelige samfund fokuserer sin forskning på de mange anvendelser af hydrogeler, polymere materialer, der indeholder en stor mængde vand, som har potentialet til
- To stier en energienhed kunne tage, indtil den strålede ud til rummet?
- Eksperter opfordrer til global reform, før en mere dødelig pandemi opstår
- er glathed en egenskab ved baser?
- Hvor lang tid tager det for energien at få Venus?
- Klimafremskrivninger viser en varmere fremtid for det nordvestlige Stillehav
- Sandhed og forsoning:Ny undersøgelse finder, at folk er mindre tilbøjelige til at anerkende krigsf…


