Hvad er den relative formelmasse af jernsulfat?
1. Identificer den kemiske formel:
* Jernsulfat er feso₄
2. Bestem atommasserne i hvert element:
* Jern (Fe):55.845 U
* Svovl (er):32.065 U
* Oxygen (O):15.999 U
3. Multiplicer atommassen for hvert element med dets underskrift i formlen:
* FE:55.845 U * 1 =55.845 U
* S:32.065 U * 1 =32.065 U
* O:15.999 U * 4 =63.996 U
4. Tilføj værdierne fra trin 3 for at få RFM:
* 55.845 U + 32.065 U + 63.996 U = 151.906 U
Derfor er den relative formelmasse af jernsulfat (feso₄) 151.906 u.
Sidste artikelHvad er det sammensatte navn for 1 nitrogen og ilt?
Næste artikelSkriv den elektroniske konfiguration af klor?
 Varme artikler
Varme artikler
-
 Betydningen af vand i en lovende biomarkør mod kræftEmilio J. Cocinero, medlem af UPV/EHUs Institut for Fysisk Kemi og Biofisika Institute har samarbejdet med Francisco Corzana fra University of La Rioja, og Ramón Hurtado fra ARAID Foundation. Kredit:E
Betydningen af vand i en lovende biomarkør mod kræftEmilio J. Cocinero, medlem af UPV/EHUs Institut for Fysisk Kemi og Biofisika Institute har samarbejdet med Francisco Corzana fra University of La Rioja, og Ramón Hurtado fra ARAID Foundation. Kredit:E -
 4-D printet termit kunne gøre svejsning i rummet og kampzoner lettere, sikrereNeelys har svejst jern (ovenfor) og kobber med den 4D-printede termitpasta. Kredit:Vanderbilt University En nyuddannet maskiningeniør har skabt et materiale til svejsning under ekstreme forhold, s
4-D printet termit kunne gøre svejsning i rummet og kampzoner lettere, sikrereNeelys har svejst jern (ovenfor) og kobber med den 4D-printede termitpasta. Kredit:Vanderbilt University En nyuddannet maskiningeniør har skabt et materiale til svejsning under ekstreme forhold, s -
 Biomaterialer til regenerering af knogle- og bruskvæv fra æbleaffaldOsteoblastceller fra en mus, der vokser på 3D-matricer og udvikles fra affald fra fødevareindustrien. Kredit:Milagros Ramos, Ángeles Martín, Malcolm Yates og Violeta Zurdo (CTB-UPM og CSIC) Forske
Biomaterialer til regenerering af knogle- og bruskvæv fra æbleaffaldOsteoblastceller fra en mus, der vokser på 3D-matricer og udvikles fra affald fra fødevareindustrien. Kredit:Milagros Ramos, Ángeles Martín, Malcolm Yates og Violeta Zurdo (CTB-UPM og CSIC) Forske -
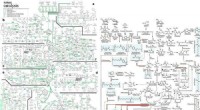 Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
- Kosmiske støvpedier kan afsløre nye typer galakser
- Her er hvad du behøver at vide om Varroa-miden
- Forskere viser, at polar 'polynya' understøttede havlivet under sidste istid
- Hvilken af disse ville ændre den retning, et objekt, men ikke påvirke hastigheden?
- Er det udbrændt eller udbrændt pære?
- Hvordan blev kromosomkort udviklet?


