Har et carbonhydrid med store molekyler et højere kogepunkt, at en små molekyler?
* Intermolekylære kræfter: De primære kræfter, der holder carbonhydridmolekyler sammen, er van der Waals Forces . Disse kræfter er svage, men de øges i styrke, når størrelsen på molekylet øges. Større molekyler har mere overfladeareal og flere elektroner, hvilket fører til stærkere van der Waals -attraktioner.
* mere energi krævet til fordampning: For at koge en væske skal du tilvejebringe nok energi til at overvinde de intermolekylære kræfter, der holder molekylerne sammen. Da større kulbrinter har stærkere intermolekylære kræfter, kræver det mere energi (og derfor en højere temperatur) for at bryde dem fra hinanden og overgangen til den gasformige tilstand.
Eksempel:
* butan (C4H10): Et lille carbonhydrid med et kogepunkt på -0,5 ° C.
* dekan (C10H22): Et større carbonhydrid med et kogepunkt på 174 ° C.
Bemærk: Forholdet mellem molekylær størrelse og kogepunkt er ikke altid ligetil. Andre faktorer, som forgrening i molekylet, kan påvirke kogepunkter. Generelt har imidlertid større carbonhydridmolekyler en tendens til at have højere kogepunkter end mindre.
Sidste artikelHvad er vand, når det er brudt i brint og ilt?
Næste artikelHvor mange atomer er der i 32 g svovl?
 Varme artikler
Varme artikler
-
 Additiv fremstilling og Ni/Ti metal forstærker køleteknologiTermodynamisk effektiv, træthed-resistente elastokaloriske kølematerialer er blevet syntetiseret ved additiv fremstilling. 3D-udskrivning af metaller tillader alsidig formdesign (f.eks. En bikage stru
Additiv fremstilling og Ni/Ti metal forstærker køleteknologiTermodynamisk effektiv, træthed-resistente elastokaloriske kølematerialer er blevet syntetiseret ved additiv fremstilling. 3D-udskrivning af metaller tillader alsidig formdesign (f.eks. En bikage stru -
 Billeddannelse af sekventielle potentielle fordelingsændringer i elektroder under opladning/afladni…Ændringer i elektrisk potentialfordeling over en sammensat katode under opladning (a – f) og udladning (g – l) processer. Kredit:National Institute for Materials Science NIMS er lykkedes for først
Billeddannelse af sekventielle potentielle fordelingsændringer i elektroder under opladning/afladni…Ændringer i elektrisk potentialfordeling over en sammensat katode under opladning (a – f) og udladning (g – l) processer. Kredit:National Institute for Materials Science NIMS er lykkedes for først -
 Kemiker skaber en effektiv katalysator til syntese af organiske sulfiderKredit:RUDN Universitet En RUDN-kemiker har fået en ny forbindelse - en håndvægt-formet fosfat-brokoblet molybdænklynge. Klyngen accelererer reaktionen af dannelsen af sulfider fra oxider og k
Kemiker skaber en effektiv katalysator til syntese af organiske sulfiderKredit:RUDN Universitet En RUDN-kemiker har fået en ny forbindelse - en håndvægt-formet fosfat-brokoblet molybdænklynge. Klyngen accelererer reaktionen af dannelsen af sulfider fra oxider og k -
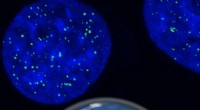 Forskere har sporet en uhåndgribelig sammenfiltret knude af DNAKunstnerens indtryk af i-motivets DNA-struktur inde i celler, sammen med det antistofbaserede værktøj, der bruges til at opdage det. Kredit:Chris Hammang Det er DNA, men ikke som vi kender det. I
Forskere har sporet en uhåndgribelig sammenfiltret knude af DNAKunstnerens indtryk af i-motivets DNA-struktur inde i celler, sammen med det antistofbaserede værktøj, der bruges til at opdage det. Kredit:Chris Hammang Det er DNA, men ikke som vi kender det. I
- Hvorfor vejer træ mindre, når man brænder det?
- Hvordan foreslog Big Bang -teorien at sprede sig fra centrum?
- NASA-forskere gør klar til solstorme på Mars
- Rapporten finder, at strengere våbenlove ikke forhindrer lovlydige borgere i at få våben
- Hvad er forskellen i fremdrift mellem et fly et rumfartøj?
- Chokolade, der udnytter kakaofrugtens fulde potentiale


