Hvad sker der med afstanden mellem molekyler, når temperaturen stiger?
* kinetisk energi: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Når temperaturen stiger, bevæger molekyler sig hurtigere og har mere kinetisk energi.
* vibrationer og kollisioner: Denne øgede energi fører til hyppigere og kraftige kollisioner mellem molekyler. Disse kollisioner får molekylerne til at skubbe længere fra hinanden.
* udvidelse: I faste stoffer, væsker og gasser resulterer denne forøgede afstand mellem molekyler i ekspansion.
Undtagelser:
Selvom dette er den generelle regel, er der nogle undtagelser:
* Vand: Vand er usædvanligt, fordi dets molekyler danner stærke brintbindinger. Efterhånden som temperaturen stiger, nedbrydes disse bindinger, hvilket fører til et * fald * i afstand mellem molekyler (op til et bestemt punkt). Dette er grunden til, at vand udvides, når det fryser, og hvorfor is flyder.
Kortfattet:
* For de fleste stoffer øger stigende temperatur afstanden mellem molekyler.
* Dette skyldes den øgede kinetiske energi af molekyler, hvilket fører til hyppigere og kraftfulde kollisioner.
* Vand er en undtagelse fra denne regel, hvor dens brintbindinger spiller en betydelig rolle.
 Varme artikler
Varme artikler
-
 CO2 som råstof til plast og andre produkterLysmikrofotografi af celler af den gramnegative bakterie-Methylorubrum extor-quens AM1. Kredit:Fraunhofer-Gesellschaft Kuldioxid er en af de vigtigste drivkræfter bag klimaændringer - hvilket be
CO2 som råstof til plast og andre produkterLysmikrofotografi af celler af den gramnegative bakterie-Methylorubrum extor-quens AM1. Kredit:Fraunhofer-Gesellschaft Kuldioxid er en af de vigtigste drivkræfter bag klimaændringer - hvilket be -
 Hvordan vand hjælper substratet ind i enzymetKredit:Pixabay/CC0 Public Domain Forskere fra Bochum og Berkeley har undersøgt, hvorfor bure kan øge den katalytiske aktivitet af lukkede molekyler. Ved at bruge terahertz-spektroskopi og kompleks
Hvordan vand hjælper substratet ind i enzymetKredit:Pixabay/CC0 Public Domain Forskere fra Bochum og Berkeley har undersøgt, hvorfor bure kan øge den katalytiske aktivitet af lukkede molekyler. Ved at bruge terahertz-spektroskopi og kompleks -
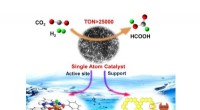 Enkeltatomskatalysator baseret på homogen katalyseprototype til CO2-transformationEn porøs organisk polymer med aminopyridin -funktionaliteter med Ir -enkeltatoms aktive steder analogt med de mononukleære Ir -pincetkomplekser blev påvist. Kredit:DICP Enkeltatomkatalysatorer (SA
Enkeltatomskatalysator baseret på homogen katalyseprototype til CO2-transformationEn porøs organisk polymer med aminopyridin -funktionaliteter med Ir -enkeltatoms aktive steder analogt med de mononukleære Ir -pincetkomplekser blev påvist. Kredit:DICP Enkeltatomkatalysatorer (SA -
 Ser man på en fremtid, hvor afisning af fly hører fortiden tilKredit:Alexey Lesik, Shutterstock Ved hjælp af nanoteknologi, forskere skaber nye flybelægninger, der afviser vand og forhindrer dannelse af is. Når is ophobes på flyoverflader, det forstyrrer fl
Ser man på en fremtid, hvor afisning af fly hører fortiden tilKredit:Alexey Lesik, Shutterstock Ved hjælp af nanoteknologi, forskere skaber nye flybelægninger, der afviser vand og forhindrer dannelse af is. Når is ophobes på flyoverflader, det forstyrrer fl
- Er frysning af kuldioxid en kemisk ændring eller fysisk ændring?
- Direkte observation af kohærens energiskala af Hunds metal
- Large Hadron Collider genstarter efter tre års pause
- Trivselsparadokset - folk bliver rigere, men ikke mere tilfreds
- Hvad er brændende papir i en masse?
- Siliciumchip med integreret laser:Lys fra en nanotråd


