Hvorfor lithium og andre gruppe 1 -elementer danner normalt positive ioner, mens fluor 17 negative ioner?
Elektronegativitet og iondannelse
* Elektronegativitet er et atoms tendens til at tiltrække elektroner mod sig selv, når det danner en kemisk binding.
* gruppe 1 -elementer (alkalimetaller): Disse elementer har lave elektronegativitetsværdier. Dette betyder, at de har et svagt greb om deres valens (yderste) elektroner. Når de reagerer, har de en tendens til at miste deres enkelt valenselektron for at opnå en stabil, fuld ydre skal som de ædle gasser. Dette tab af et elektron skaber en positiv ion (kation).
* fluor (gruppe 17, halogener): Fluor har en meget høj elektronegativitet. Det er meget ivrig efter at få en elektron for at afslutte sin ydre skal og opnå en stabil ædelgaskonfiguration. Denne gevinst af en elektron resulterer i en negativ ion (anion).
Eksempel:
* Lithium (Li) har en valenselektron. Det mister let dette elektron for at blive li⁺.
* Fluor (F) har syv valenselektroner. Det får let en elektron for at blive f⁻.
ioniske bindinger:
De modsatte ladninger af li⁺ og f⁻ tiltrækker hinanden stærkt og danner en ionisk binding i forbindelsen lithiumfluorid (LIF).
Kortfattet:
Gruppe 1 -elementer (som lithium) mister elektroner for at blive positivt ladede ioner, fordi de har lav elektronegativitet. Fluor med høj elektronegativitet vinder elektroner til at blive negativt ladede ioner. Denne forskel i elektronegativitet er drivkraften bag dannelsen af ioniske bindinger.
 Varme artikler
Varme artikler
-
 Proteinmiljøet gør katalysatoren effektiv til brintproduktionBochum -forskerne Martin Winkler, Oliver Lampret og Thomas Happe (fra venstre mod højre) sammen med Olaf Rüdiger (i baggrunden) fra Max Planck Institute. Kredit:RUB, Marquard Interaktionen mellem
Proteinmiljøet gør katalysatoren effektiv til brintproduktionBochum -forskerne Martin Winkler, Oliver Lampret og Thomas Happe (fra venstre mod højre) sammen med Olaf Rüdiger (i baggrunden) fra Max Planck Institute. Kredit:RUB, Marquard Interaktionen mellem -
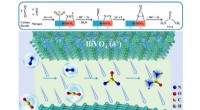 Nye katalysatorer forbedrer effektiviteten af urinstofsyntese ved omgivende betingelserDen skematiske elektrokatalytiske ureasyntesemekanisme baseret på Bi-BiVO 4 Mott-Schottky heterostruktur synergistiske effekter Kredit:Zhang Guangjin og Yuan Menglei Konvertering af både nitroge
Nye katalysatorer forbedrer effektiviteten af urinstofsyntese ved omgivende betingelserDen skematiske elektrokatalytiske ureasyntesemekanisme baseret på Bi-BiVO 4 Mott-Schottky heterostruktur synergistiske effekter Kredit:Zhang Guangjin og Yuan Menglei Konvertering af både nitroge -
 Lindring af antibiotikaresistens:Forskere tager skridt mod ny behandling af E. coliPhilip Hardwidge, professor i diagnostisk medicin og patobiologi ved Kansas State Universitys College of Veterinary Medicine, ret, og Samir El Qaidi, postdoc forsker, forsker i nye måder at behandle E
Lindring af antibiotikaresistens:Forskere tager skridt mod ny behandling af E. coliPhilip Hardwidge, professor i diagnostisk medicin og patobiologi ved Kansas State Universitys College of Veterinary Medicine, ret, og Samir El Qaidi, postdoc forsker, forsker i nye måder at behandle E -
 At finde generne til at bygge en bedre kræftbehandlingPacific Yew bark. Kredit:Walter Siegmund / Wikimedia / CC BY 2.5 Forskere er et skridt tættere på at forstå, hvordan det kræftbekæmpende stof Taxol produceres af træer. I en nylig artikel offentl
At finde generne til at bygge en bedre kræftbehandlingPacific Yew bark. Kredit:Walter Siegmund / Wikimedia / CC BY 2.5 Forskere er et skridt tættere på at forstå, hvordan det kræftbekæmpende stof Taxol produceres af træer. I en nylig artikel offentl
- Når der leveres varme til et fast stof, hvad sker der energien?
- Sådan fungerer byspredning
- At indkredse, hvordan naturens fordele hænger sammen med menneskers velvære
- Hvor kommer energien fra den kræfter fordampning i naturen?
- Hvorfor du skal blive på nettet, selv med dine solcelledrevne batterier
- Nanosølv til terapi og diagnostik


