Hvor mange iltatomer er til stede i en 14,0 g prøve af Cu (NO3) 2?
1. Find den molære masse af Cu (NO3) 2
* CU:63,55 g/mol
* N:14,01 g/mol (x2 fordi der er to nitrogenatomer)
* O:16,00 g/mol (x6 fordi der er seks iltatomer)
Molmasse Cu (NO3) 2 =63,55 + (14,01 x 2) + (16,00 x 6) =187,57 g/mol
2. Beregn antallet af mol Cu (NO3) 2
* mol =masse / molær masse
* mol =14,0 g / 187,57 g / mol =0,0746 mol
3. Bestem antallet af mol iltatomer
* Der er 6 mol iltatomer for hver 1 mol Cu (NO3) 2.
* Mol ilt =0,0746 mol Cu (NO3) 2 * (6 mol O / 1 mol Cu (NO3) 2) =0,4476 mol o
4. Beregn antallet af iltatomer
* Brug Avogadros nummer (6.022 x 10^23 atomer/mol) til at omdanne mol ilt til atomer.
* Antal iltatomer =0,4476 mol o * (6,022 x 10^23 atomer/mol) = 2,69 x 10^23 Oxygenatomer
Derfor er der ca. 2,69 x 10^23 iltatomer i en 14,0 g prøve af Cu (NO3) 2.
 Varme artikler
Varme artikler
-
 En polymer kærlighedshormonsensor til tidlig påvisning af autismeSmå mængder oxytocin, en af autismens biomarkører, kan detekteres af en ny kemisk sensor, designet og fremstillet på Institute of Physical Chemistry ved det polske videnskabsakademi i Warszawa. Kred
En polymer kærlighedshormonsensor til tidlig påvisning af autismeSmå mængder oxytocin, en af autismens biomarkører, kan detekteres af en ny kemisk sensor, designet og fremstillet på Institute of Physical Chemistry ved det polske videnskabsakademi i Warszawa. Kred -
 Enkelt molekyle kontrol i en milliontedel af en milliardtedel af et sekundScanning Tunneling Mikroskop. Kredit:University of Bath Fysikere ved University of Bath har opdaget, hvordan man manipulerer og kontrollerer individuelle molekyler i en milliontedel af en milliard
Enkelt molekyle kontrol i en milliontedel af en milliardtedel af et sekundScanning Tunneling Mikroskop. Kredit:University of Bath Fysikere ved University of Bath har opdaget, hvordan man manipulerer og kontrollerer individuelle molekyler i en milliontedel af en milliard -
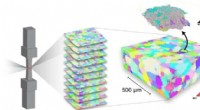 3D-eksperimenter kaster nyt lys over formhukommelseslegeringerUdviklingen af den interne mikrostruktur af en nikkel-titaniumprøve måles, mens den testes mekanisk. Farverne svarer til krystallografisk orientering, og orienteringerne er samlet i korn, eller krys
3D-eksperimenter kaster nyt lys over formhukommelseslegeringerUdviklingen af den interne mikrostruktur af en nikkel-titaniumprøve måles, mens den testes mekanisk. Farverne svarer til krystallografisk orientering, og orienteringerne er samlet i korn, eller krys -
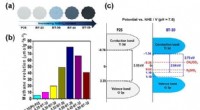 Meget effektiv fotokatalysator, der omdanner kuldioxid til metan(a) Figuren viser farveændringen af fotokatalysatoren udviklet af forskerholdet. Den viser, at den reducerede titaniumdioxid absorberer lys mere mod højre, og farven bliver mørkere.(b) En graf, der
Meget effektiv fotokatalysator, der omdanner kuldioxid til metan(a) Figuren viser farveændringen af fotokatalysatoren udviklet af forskerholdet. Den viser, at den reducerede titaniumdioxid absorberer lys mere mod højre, og farven bliver mørkere.(b) En graf, der


