Hvorfor er den metalliske binding i aluminium stærkere end natrium?
* mindre atomstørrelse: Aluminiumatomer er mindre end natriumatomer. Dette betyder, at aluminiumskernen har en stærkere tiltrækning til valenselektronerne, hvilket fører til en højere elektrondensitet i det metalliske gitter.
* Højere antal valenselektroner: Aluminium har tre valenselektroner, mens natrium kun har en. Dette betyder, at aluminium har flere elektroner til rådighed for at deltage i den metalliske binding, hvilket fører til en stærkere binding.
* Højere ladningstæthed: Den mindre størrelse og højere antal valenselektroner i aluminium resulterer i en højere ladningstæthed inden for det metalliske gitter. Denne større opladningskoncentration styrker de attraktive kræfter mellem de positive metalioner og de delokaliserede elektroner.
Kortfattet: Kombinationen af mindre atomstørrelse, et højere antal valenselektroner og højere ladningstæthed i aluminium fører til en stærkere metallisk binding sammenlignet med natrium. Dette resulterer i, at aluminium har et højere smeltepunkt, et højere kogepunkt og at være stærkere og mere resistent over for deformation end natrium.
 Varme artikler
Varme artikler
-
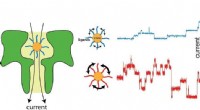 Med nanopore sansning, fysikforskere opdager subtile ændringer i enkelte partiklerResistiv puls nanopore sensing er baseret på ideen om, at små ændringer i strømmen, der bevæger sig gennem en nanopore (grøn, venstre) kan bruges til at lære om molekyler indeholdt. Forskerne var i st
Med nanopore sansning, fysikforskere opdager subtile ændringer i enkelte partiklerResistiv puls nanopore sensing er baseret på ideen om, at små ændringer i strømmen, der bevæger sig gennem en nanopore (grøn, venstre) kan bruges til at lære om molekyler indeholdt. Forskerne var i st -
 Kantarelsvampe som smagsforstærkerDr. Verena Mittermeier fra formanden for fødevarekemi og molekylær sensorisk videnskab og Andreas Dunkel fra Leibniz-instituttet for fødevaresystembiologi foran deres institut. Kredit:Leibniz-LSB@TUM
Kantarelsvampe som smagsforstærkerDr. Verena Mittermeier fra formanden for fødevarekemi og molekylær sensorisk videnskab og Andreas Dunkel fra Leibniz-instituttet for fødevaresystembiologi foran deres institut. Kredit:Leibniz-LSB@TUM -
 Stabilt supramolekylært struktursystem til at identificere aktivitetsoprindelse for kuldioxidelektr…(a) Sammenligning af forskellige molekylære strukturer og katalytiske steder (Ni-TPYP, Ni-TPYP-1, Ni-TPP og TPYP), (b, c) Beregnet fri energiprofil til CO2 -reduktionsreaktion mod produktion af CO, (d
Stabilt supramolekylært struktursystem til at identificere aktivitetsoprindelse for kuldioxidelektr…(a) Sammenligning af forskellige molekylære strukturer og katalytiske steder (Ni-TPYP, Ni-TPYP-1, Ni-TPP og TPYP), (b, c) Beregnet fri energiprofil til CO2 -reduktionsreaktion mod produktion af CO, (d -
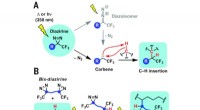 En ny form for lim til at binde polyethylenEn bis-diazirin-strategi til polymertværbinding. (A) Mekanisme for carbendannelse fra lys- eller varmefremkaldt nedbrydning af diaziriner, efterfulgt af C – H indsættelse. hν, ultraviolet lys. (B) Tvæ
En ny form for lim til at binde polyethylenEn bis-diazirin-strategi til polymertværbinding. (A) Mekanisme for carbendannelse fra lys- eller varmefremkaldt nedbrydning af diaziriner, efterfulgt af C – H indsættelse. hν, ultraviolet lys. (B) Tvæ
- Lettere fortov gør virkelig fede byer, når det er gjort rigtigt
- Hvor langt i fødder falder et objekt 2 sekunder?
- Hvad er den nyttige energioverførsel i en vindmølle og generator?
- Hvordan forårsager planter og dyr biologisk weatering?
- Hvad er det samlede antal konstellation?
- LHCb ser på fremtiden med SciFi-detektor


