Hvorfor udfører hydrogenchlorid ikke elektricitet, når de opløses i hexan, men udfører valgvand?
Hvorfor HCL udfører elektricitet i vand:
* ionisering: Når HCL opløses i vand, gennemgår den ionisering. Dette betyder, at HCL-molekylerne går i stykker i hydrogenioner (H+) og chloridioner (Cl-). Disse ioner er frie til at bevæge sig gennem opløsningen.
* opladningsbærere: Tilstedeværelsen af disse mobile, ladede ioner giver mulighed for strøm af elektricitet. Når et elektrisk potentiale påføres, bevæger de positive hydrogenioner mod den negative elektrode, og de negative chloridioner bevæger sig mod den positive elektrode og afslutter et elektrisk kredsløb.
hvorfor HCL ikke udfører elektricitet i hexan:
* Ikke-polært opløsningsmiddel: Hexan er et ikke-polært opløsningsmiddel. Dette betyder, at det ikke har en signifikant adskillelse af ladning inden for dets molekyler. Det tiltrækker ikke HCL -molekylerne stærkt nok til at få dem til at ionisere.
* Ingen frie ioner: Fordi HCL ikke ioniserer i hexan, er der ingen frie ioner til at bære en elektrisk strøm. Opløsningen forbliver elektrisk neutral.
Kortfattet:
Den vigtigste forskel ligger i opløsningsmidlets evne til at bryde HCL -molekylerne fra hinanden og danne frie ioner. Vand, der er et polært opløsningsmiddel, fremmer ionisering, mens hexan, der er ikke-polær, ikke gør det.
 Varme artikler
Varme artikler
-
 Ny stofbelægning kunne forhindre kemiske våben, redde livEn ny stofbelægning kunne neutralisere kemiske våben og hjælpe med at redde utallige liv. Kredit:American Chemical Society Kemiske våben er mareridtsagtige. På et millisekund, de kan dræbe hundred
Ny stofbelægning kunne forhindre kemiske våben, redde livEn ny stofbelægning kunne neutralisere kemiske våben og hjælpe med at redde utallige liv. Kredit:American Chemical Society Kemiske våben er mareridtsagtige. På et millisekund, de kan dræbe hundred -
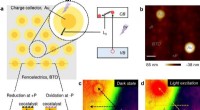 Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok,
Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok, -
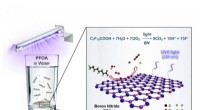 Bornitrid ødelægger for evigt kemikalier PFOA, GenXEn illustration af bornitrid-fotokatalyse, der ødelægger det forurenende stof PFOA i vand. Kredit:Billede udlånt af M. Wong/Rice University Rice University kemiingeniører fandt en effektiv katalys
Bornitrid ødelægger for evigt kemikalier PFOA, GenXEn illustration af bornitrid-fotokatalyse, der ødelægger det forurenende stof PFOA i vand. Kredit:Billede udlånt af M. Wong/Rice University Rice University kemiingeniører fandt en effektiv katalys -
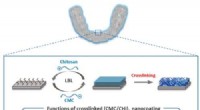 Hjælper tandholdere og aligners med at bekæmpe bakterierKredit:American Chemical Society Klar, plast aligners er vokset i popularitet som alternativer til voluminøse, metal seler. Og når tænderne er rettet, patienter opgraderer til plastikholdere for a
Hjælper tandholdere og aligners med at bekæmpe bakterierKredit:American Chemical Society Klar, plast aligners er vokset i popularitet som alternativer til voluminøse, metal seler. Og når tænderne er rettet, patienter opgraderer til plastikholdere for a
- Hvordan kan en bils hastighed under brud ved konstant acceleration i forhold til tiden fra tidspunkt…
- Hvad er effekten på drifthastighed af frie elektroner ved faldende længde og temperaturtråd?
- Hvad er virkningerne af stenbrud på planter?
- Store transnationale virksomheder spiller en afgørende rolle i den globale forvaltning af naturress…
- Forstyrrer krystallinsk orden for at genoprette overflødighed
- Liste over jordarter Ressourcer


