Grundlaget for VSEPR -modellen er molekylær binding?
Her er en sammenbrud:
* Elektronpar: Dette inkluderer både bindingspar (involveret i kovalente bindinger) og ensomme par (ikke-bondende elektroner).
* frastødning: Afvisningen mellem disse elektronpar er elektrostatisk. Enlige par er mere spredt og udøver en stærkere frastødende kraft end bindingspar.
* minimering af frastødning: Elektronerne arrangerer sig omkring det centrale atom på en måde, der minimerer frastødelsen mellem dem. Dette fører til specifikke geometriske arrangementer af atomer, såsom lineær, trigonal plan, tetrahedral, trigonal bipyramidal og octahedral.
Nøglekoncepter:
* Antallet af elektronpar omkring det centrale atom bestemmer den grundlæggende form af molekylet.
* Enlige par har en større effekt på bindingsvinkler end bindingspar.
* VSEPR -modellen giver en relativt enkel og effektiv måde at forudsige formen på molekyler.
Eksempel:
Overvej vandmolekylet (H₂O):
1. ilt har to ensomme par og to bindingspar.
2. For at minimere frastødning er de ensomme par placeret så langt væk fra hinanden som muligt, hvilket resulterer i en bøjet eller V-formet geometri.
Kortfattet: VSEPR -modellen fokuserer på samspillet mellem elektronpar for at forklare de observerede former af molekyler.
Sidste artikelHvilken type intermolekylære kræfter har metan CH4?
Næste artikelHvad er hydrogenbrom og kulstof kombineret?
 Varme artikler
Varme artikler
-
 Ekspert:Brug af kulstof er nøglen til at dekarbonisere økonomiMatteo Pasquali fra Rice University er kemiingeniør, kemiker, materialeforsker og direktør for forskningsinitiativet Carbon Hub. Kredit:Jeff Fitlow/Rice University Rice Universitys kulstofmaterial
Ekspert:Brug af kulstof er nøglen til at dekarbonisere økonomiMatteo Pasquali fra Rice University er kemiingeniør, kemiker, materialeforsker og direktør for forskningsinitiativet Carbon Hub. Kredit:Jeff Fitlow/Rice University Rice Universitys kulstofmaterial -
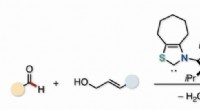 Partnere i katalyse:En effektiv vej til umættede ketonerDen samvirkende virkning af en organokatalysator og en palladiumkatalysator muliggjorde en første dehydrerende direkte allylering mellem aldehyder og allylalkoholer for at producere β, γ-umættede keto
Partnere i katalyse:En effektiv vej til umættede ketonerDen samvirkende virkning af en organokatalysator og en palladiumkatalysator muliggjorde en første dehydrerende direkte allylering mellem aldehyder og allylalkoholer for at producere β, γ-umættede keto -
 Udfordrer en central grundsætning i kemiKredit:CC0 Public Domain Steve Granick, Direktør for IBS Center for Soft and Living Matter og Dr. Huan Wang, Seniorforsker, rapport sammen med 5 tværfaglige kolleger i tidsskriftets 31. juli-udgav
Udfordrer en central grundsætning i kemiKredit:CC0 Public Domain Steve Granick, Direktør for IBS Center for Soft and Living Matter og Dr. Huan Wang, Seniorforsker, rapport sammen med 5 tværfaglige kolleger i tidsskriftets 31. juli-udgav -
 Forskere sender DNA på sekventiel byggemissionEt hold videnskabsmænd har udviklet en metode til at skabe strukturer, hvis byggesten er en milliontedel af en meter store ved at kode DNA med monteringsvejledninger. I en række eksperimenter, forsker
Forskere sender DNA på sekventiel byggemissionEt hold videnskabsmænd har udviklet en metode til at skabe strukturer, hvis byggesten er en milliontedel af en meter store ved at kode DNA med monteringsvejledninger. I en række eksperimenter, forsker
- Californiens naturbrande er nogle af de største i statens historie
- Sedimentære klipper, der består af store småsten og sten, har en grovkornet?
- Hvilket svampet væv holder dine knogler sammen?
- Kan aminosyrer også udvikles som pesticid mod plantevirus?
- Hvad koder kodoner for ud over aminosyrer?
- Når en baseballspiller holder flagermus, hvilken slags energi har det?


