Hvilken type intermolekylære kræfter har metan CH4?
Her er hvorfor:
* ikke -polær: Methan er et ikke -polært molekyle på grund af dens tetrahedrale form og lige deling af elektroner mellem kulstof og brint.
* Ingen dipol-dipol: Ikke-polære molekyler har ikke permanente dipoler, så dipol-dipolinteraktioner er ikke til stede.
* Ingen hydrogenbinding: Hydrogenbinding kræver et hydrogenatom, der er direkte bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor. Metan har ikke nogen af disse.
London Dispersion Forces (LDFS): Dette er den svageste type intermolekylær kraft og stammer fra midlertidige udsving i elektronfordeling omkring molekylet. Selvom methan i gennemsnit ikke er polært, skaber disse midlertidige udsving midlertidige dipoler, der kan inducere dipoler i nærliggende metanmolekyler, hvilket resulterer i svage attraktioner.
Derfor er den eneste intermolekylære kraft, der er til stede i metan, London Dispersion Forces.
Sidste artikelEr ilt element eller sammensætning?
Næste artikelGrundlaget for VSEPR -modellen er molekylær binding?
 Varme artikler
Varme artikler
-
 Ingeniører evaluerer de faktorer, der påvirker batteriets ydeevne ved lave temperaturerKredit:CC0 Public Domain Energilagring med genopladelige batteriteknologier driver vores digitale livsstil og understøtter integration af vedvarende energi i elnettet. Batterifunktion under kolde f
Ingeniører evaluerer de faktorer, der påvirker batteriets ydeevne ved lave temperaturerKredit:CC0 Public Domain Energilagring med genopladelige batteriteknologier driver vores digitale livsstil og understøtter integration af vedvarende energi i elnettet. Batterifunktion under kolde f -
 At gøre polyurethan nedbrydeligt giver dets komponenter et nyt livDet nedbrydelige polyurethanmateriale (lyserød strimmel) kvælder og opløses derefter i syre blandet med et organisk opløsningsmiddel (venstre hætteglas på begge billeder), men ikke når det placeres i
At gøre polyurethan nedbrydeligt giver dets komponenter et nyt livDet nedbrydelige polyurethanmateriale (lyserød strimmel) kvælder og opløses derefter i syre blandet med et organisk opløsningsmiddel (venstre hætteglas på begge billeder), men ikke når det placeres i -
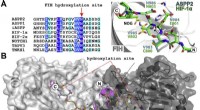 Hydroxyleringen af ASPP2 og andre ankyrin-gentagelsesdomæneproteinerUdsigter fra krystalstrukturer af FIH i kompleks med ASPP-afledte peptider. En (venstre) sekvensjustering af ASPP-proteiner med rapporterede FIH-substrater. (Højre) Overlejring af krystalstrukturafled
Hydroxyleringen af ASPP2 og andre ankyrin-gentagelsesdomæneproteinerUdsigter fra krystalstrukturer af FIH i kompleks med ASPP-afledte peptider. En (venstre) sekvensjustering af ASPP-proteiner med rapporterede FIH-substrater. (Højre) Overlejring af krystalstrukturafled -
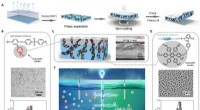 En mere effektiv membranbaseret generator til høst af osmotisk kraft (opdatering)Skematisk afbildning af Janus 3D porøs membranbaseret osmotisk kraftgenerator. (A) Forberedelsesproces af Janus nanoporøse membran. (B og D) Kemisk struktur (øverst), mikrostruktur af ionomerer (midte
En mere effektiv membranbaseret generator til høst af osmotisk kraft (opdatering)Skematisk afbildning af Janus 3D porøs membranbaseret osmotisk kraftgenerator. (A) Forberedelsesproces af Janus nanoporøse membran. (B og D) Kemisk struktur (øverst), mikrostruktur af ionomerer (midte
- Hvilke har de mest energipartikler i damp flydende vandis eller frysevand?
- Sådan identificeres de forskellige typer af alveolarceller
- Hvad mener du med forbrænding af et carbonhydrid?
- Kupler af frossen metan kan være advarselstegn for nye udblæsninger
- Hjælper EU byer og regioner med at reducere CO2 -udledningen
- Udgravning af en Hispano-Visigotisk grav ved Ojo Guareña


