Hvilket stof har den største duktilitet NaCl Fe SiO2 C?
* duktilitet henviser til et materiales evne til at blive trukket ind i en ledning uden at bryde. Dette bestemmes i vid udstrækning af typen af tilstedeværende binding og arrangementet af atomer.
* NaCl (natriumchlorid) er en ionisk forbindelse. Ioniske bindinger er stærke, men sprøde, hvilket betyder, at de let bryder under stress. Dette gør NaCl meget ikke duktil.
* siO2 (siliciumdioxid) er et kovalent netværk solidt. Mens obligationerne er stærke, gør den stive struktur den meget sprød. Dette gør SiO2 ikke duktil.
* c (carbon) kan eksistere i forskellige former som diamant og grafit. Diamond er ekstremt hård, men sprød, hvilket gør det ikke duktil. Grafit er lagdelt og noget duktil, men ikke så meget som jern.
* Fe (jern) er et metal. Metaller har en metallisk bindingsstruktur, hvor elektroner delokaliseres. Dette gør det muligt for atomer at glide forbi hinanden, hvilket gør dem meget duktile.
Derfor har Iron (Fe) den største duktilitet ud af de anførte indstillinger.
Sidste artikelHvad er den molære masse af natriumsulfat?
Næste artikelHvad er der for det meste fremstillet af kulstof- og hydrogenatomer?
 Varme artikler
Varme artikler
-
 Kemikere bringer blandede foldede proteiner til liveDen aluminiumoxid nanopartikel-assisteret enzym genfoldning proces er vist. Kredit:ITMO University Forskere fra ITMO University i Sankt Petersborg og Hebrew University i Jerusalem har fundet en må
Kemikere bringer blandede foldede proteiner til liveDen aluminiumoxid nanopartikel-assisteret enzym genfoldning proces er vist. Kredit:ITMO University Forskere fra ITMO University i Sankt Petersborg og Hebrew University i Jerusalem har fundet en må -
 Sikring af broccolispirer bevarer deres kræftbekæmpende forbindelserKredit:CC0 Public Domain Rå broccolispirer, en rig kilde til potentielle kræftbekæmpende forbindelser, er blevet en populær helsekost i de seneste år. Men konventionel varmebehandling, der bruges
Sikring af broccolispirer bevarer deres kræftbekæmpende forbindelserKredit:CC0 Public Domain Rå broccolispirer, en rig kilde til potentielle kræftbekæmpende forbindelser, er blevet en populær helsekost i de seneste år. Men konventionel varmebehandling, der bruges -
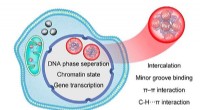 Molekylær mekanisme for ruthenium-kompleks-induceret DNA-faseseparation afsløretMekanismerne til DNA -faseseparation induceret af rutheniumkompleks. Kredit:ZHANG Yuebin og LI Guohui Fænomenet væske-væske faseseparation (LLPS) af biologiske makromolekyler i levende celler regu
Molekylær mekanisme for ruthenium-kompleks-induceret DNA-faseseparation afsløretMekanismerne til DNA -faseseparation induceret af rutheniumkompleks. Kredit:ZHANG Yuebin og LI Guohui Fænomenet væske-væske faseseparation (LLPS) af biologiske makromolekyler i levende celler regu -
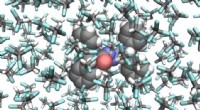 Forskere laver en fotografisk film af en molekylær switchMolekylær struktur af den fotoresponsive molekylære switch (i midten) omgivet af opløsningsmiddelmolekyler. Forskerne afslørede en lys-induceret pedalo-type bevægelse, som går både frem og tilbage. Bi
Forskere laver en fotografisk film af en molekylær switchMolekylær struktur af den fotoresponsive molekylære switch (i midten) omgivet af opløsningsmiddelmolekyler. Forskerne afslørede en lys-induceret pedalo-type bevægelse, som går både frem og tilbage. Bi
- Hvilken energiressource tager sin varme fra underjordiske klipper?
- Hvordan påvirker afstanden, det tager Jorden og andre planeter at gå rundt i solen?
- NASAs Aqua-satellit ser Tropical Depression 01W ende nær det sydlige Vietnam
- Vil et objekt med en masse på 0,33n flyde?
- Forskere afslører et århundreder gammelt tilfælde af fejlagtig identitet i Chesapeake Bay
- Maskinlæring til solenergi er en supercomputer dræber


