Når man sammenligner elektronkonfigurationer af neon og fluor, hvad skal der ske for at blive stabil?
Elektronkonfigurationer
* neon (NE): 1S² 2S² 2P⁶
* fluor (F): 1S² 2S² 2P⁵
stabilitet og oktetreglen
Atomer stræber efter stabilitet ved at opnå en fuld ydre skal af elektroner. Dette er kendt som octet -reglen (Bortset fra brint og helium, som kun har brug for 2 elektroner i deres ydre skal).
* neon: Neon har allerede en fuld ydre skal (8 elektroner i 2p -underskalet). Dette gør det meget stabilt og ureaktivt.
* fluor: Fluor har 7 elektroner i sin ydre skal (2S² 2P⁵). Det er kun en elektron væk fra at have en fuld ydre skal.
for at blive stabil, fluor vil:
* få en elektron: Dette skaber en fluorion (F⁻) med en komplet ydre skal (1S² 2S² 2P⁶) som neon. Dette er grunden til, at fluor er meget elektronegativ og har en tendens til at danne ioniske bindinger og få et elektron fra et andet atom.
Nøglepunkter
* Atomer med fulde ydre skaller er meget stabile og mindre tilbøjelige til at reagere.
* Atomer med ufuldstændige ydre skaller er mere reaktive og vil forsøge at vinde eller miste elektroner for at opnå en fuld ydre skal.
* Octet -reglen er et vejledende princip for forståelse af kemisk binding og reaktivitet.
Sidste artikelNettoionisk ligning for jernnitrat og ammoniak?
Næste artikelHvor mange atomer er der i natriumacetat?
 Varme artikler
Varme artikler
-
 At tænke uden for buret:En ny tilgang til energiintensive molekylære adskillelserKAUST-forskere udvikler organiske burlignende materialer til at adskille xylenisomerer på en mere energieffektiv måde. Kredit:KAUST; Anastasia Serin En omvendt form for vært-gæstekemi kunne hæmme
At tænke uden for buret:En ny tilgang til energiintensive molekylære adskillelserKAUST-forskere udvikler organiske burlignende materialer til at adskille xylenisomerer på en mere energieffektiv måde. Kredit:KAUST; Anastasia Serin En omvendt form for vært-gæstekemi kunne hæmme -
 Starten på en ny æra inden for stamcelleterapiKredit:Koc University En nylig undersøgelse offentliggjort i 8. april-udgaven af Naturens kemiske biologi forbedrer metoden Cellular Reprogramming udviklet af Nobelpristageren i medicin og fysio
Starten på en ny æra inden for stamcelleterapiKredit:Koc University En nylig undersøgelse offentliggjort i 8. april-udgaven af Naturens kemiske biologi forbedrer metoden Cellular Reprogramming udviklet af Nobelpristageren i medicin og fysio -
 Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator
Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator -
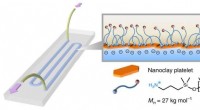 Bro over koblede farvande:Forskere 3-D-printer laboratorium med fuld væske på en chipNår to væsker - den ene indeholder nanoskala lerpartikler, en anden indeholdende polymerpartikler - er trykt på et glassubstrat, de kommer sammen ved grænsefladen mellem de to væsker og danner inden f
Bro over koblede farvande:Forskere 3-D-printer laboratorium med fuld væske på en chipNår to væsker - den ene indeholder nanoskala lerpartikler, en anden indeholdende polymerpartikler - er trykt på et glassubstrat, de kommer sammen ved grænsefladen mellem de to væsker og danner inden f
- Billede:Clarence Strait, Australien
- Frisk antimaterialeundersøgelse vil styrke fremtidige indirekte søgninger efter mørkt stof
- Kan du se andre planeter med et teleskop?
- Kan vi estimere tiden indtil den næste recession?
- To SwRI-eksperimenter flyver ombord på Blue Origins nye Shepard suborbitale raket
- Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske celler


