Hvilken type binding danner aluminium og fluor?
* aluminium (AL) er et metal, og det har en tendens til at miste tre elektroner for at opnå en stabil elektronkonfiguration. Dette skaber en positivt ladet aluminiumion (al³⁺).
* fluor (f) er en ikke -metal, og det har en tendens til at få en elektron for at opnå en stabil elektronkonfiguration. Dette skaber en negativt ladet fluorionion (F⁻).
Den stærke elektrostatiske attraktion mellem den positivt ladede aluminiumion og de negativt ladede fluorioner resulterer i dannelsen af en ionisk forbindelse, aluminiumfluorid (alf₃) .
Sidste artikelHvilken form flade lag af cabon -atomer?
Næste artikelHvor den kemiske reaktion finder sted i en celle?
 Varme artikler
Varme artikler
-
 Detektering af ethylen, frugtmodningshormonetFigur viser den potentielle anvendelse af anvendelse af fluorescerende sonde til påvisning af ethylengas under modningsprocesser af frugter. I nærvær af ethylengas, fluoroforerne i proberne aktiveres
Detektering af ethylen, frugtmodningshormonetFigur viser den potentielle anvendelse af anvendelse af fluorescerende sonde til påvisning af ethylengas under modningsprocesser af frugter. I nærvær af ethylengas, fluoroforerne i proberne aktiveres -
 Nyt superomnifobisk glas svæver højt på sommerfuglevingerne ved hjælp af maskinlæringKredit:CC0 Public Domain Glas til teknologier som displays, tabletter, bærbare computere, smartphones, og solceller skal passere lys igennem, men kunne drage fordel af en overflade, der afviser va
Nyt superomnifobisk glas svæver højt på sommerfuglevingerne ved hjælp af maskinlæringKredit:CC0 Public Domain Glas til teknologier som displays, tabletter, bærbare computere, smartphones, og solceller skal passere lys igennem, men kunne drage fordel af en overflade, der afviser va -
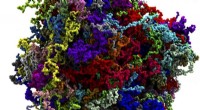 Mystiske cellulære dråber kommer i fokusIndividuelle proteinmolekyler, der udgør kondensatet, fremhæves med farve. Kredit:Han-Yi Chou, University of Illinois, Urbana-Champaign Verden inde i den menneskelige celle er blevet en smule mere
Mystiske cellulære dråber kommer i fokusIndividuelle proteinmolekyler, der udgør kondensatet, fremhæves med farve. Kredit:Han-Yi Chou, University of Illinois, Urbana-Champaign Verden inde i den menneskelige celle er blevet en smule mere -
 Video:Skal du tisse på et vandmandsstik?Kredit:The American Chemical Society Jo da, maneter ser temmelig rolige ud, men vi kender alle ondskaberne, der kommer fra et tilløb med de fangarme. Du har sikkert hørt rygtet om, at tisse på et
Video:Skal du tisse på et vandmandsstik?Kredit:The American Chemical Society Jo da, maneter ser temmelig rolige ud, men vi kender alle ondskaberne, der kommer fra et tilløb med de fangarme. Du har sikkert hørt rygtet om, at tisse på et
- Selvkørende tankeløse små robotter arbejder sammen om at flytte en korral
- Hvorfor pegede Lodestone mod nord?
- Hvad er definitionen for refleksion inden for fysikfelt?
- Farvede mennesker mere udsat for varmeøer, undersøgelse finder
- Hvad er mere tilbøjelige til at danne en ionisk binding en silicium og ilt B C carbon hydrogen D ma…
- Hvordan landet genopretter sig efter naturbrande - mener en ekspert


