Hvilke roller spiller elektronegativitet ved at bestemme, om en binding er polær eller ikke-polær?
Elektronegativitet:
* Definition: Elektronegativitet er målet for et atoms evne til at tiltrække elektroner mod sig selv, når det er en del af en kemisk binding.
* Trend: Elektronegativitet stiger generelt i en periode (fra venstre til højre) og falder ned i en gruppe i den periodiske tabel.
polære obligationer:
* dannelse: Polære bindinger forekommer, når to atomer med signifikant forskellige elektronegativiteter deler elektroner. Atomet med højere elektronegativitet vil tiltrække de delte elektroner stærkere, hvilket skaber en delvis negativ ladning (Δ-) på dette atom og en delvis positiv ladning (Δ+) på det andet atom.
* Eksempel: I et vandmolekyle (H₂O) har ilt en højere elektronegativitet end brint. De delte elektroner tilbringer mere tid omkring iltatomet, hvilket giver det en delvis negativ ladning og forlader brintatomerne med delvis positive ladninger.
Ikke-polære bindinger:
* dannelse: Ikke-polære bindinger forekommer, når to atomer med lignende eller identiske elektronegativiteter deler elektroner lige. Der er ingen signifikant forskel i elektrondensitet mellem de to atomer.
* Eksempel: I et metanmolekyle (CH₄) har kulstof og brint lignende elektronegativiteter. Elektronerne deles næsten lige mellem carbon- og brintatomerne, hvilket gør bindingerne ikke-polære.
Nøglepunkter:
* Forskel i elektronegativitet: Jo større forskellen i elektronegativitet mellem to atomer, jo mere polær er bindingen.
* Polaritetsskala: Obligationer overvejes generelt:
* ikke-polær: Hvis elektronegativitetsforskellen er mindre end 0,5.
* polær: Hvis elektronegativitetsforskellen er mellem 0,5 og 1,7.
* ionisk: Hvis elektronegativitetsforskellen er større end 1,7. (Dette er ikke ægte kovalente bindinger, men snarere ioniske bindinger.)
Sammenfattende er elektronegativitet en grundlæggende faktor til bestemmelse af arten af kemiske bindinger. Forskellen i elektronegativitet mellem to atomer påvirker direkte fordelingen af elektroner inden for bindingen, hvilket fører til enten polære eller ikke-polære egenskaber.
 Varme artikler
Varme artikler
-
 En milepæl inden for ultrahurtig gelfremstilling fra ukonventionelle selvhelbredende ædelmetalgele…Ultrahurtig gelfremstilling. Kredit:Ran DU et al. Sage 2020. Elektrokatalyse er i vid udstrækning involveret i mange vigtige energirelaterede processer, såsom oxygenreduktionsreaktionen (ORR) for
En milepæl inden for ultrahurtig gelfremstilling fra ukonventionelle selvhelbredende ædelmetalgele…Ultrahurtig gelfremstilling. Kredit:Ran DU et al. Sage 2020. Elektrokatalyse er i vid udstrækning involveret i mange vigtige energirelaterede processer, såsom oxygenreduktionsreaktionen (ORR) for -
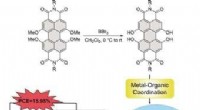 Organisk farvestof i zinkoxidmellemlag stabiliserer og øger ydeevnen af organiske solcellerKredit:Wiley Organiske solceller er lavet af billige og rigelige materialer, men deres effektivitet og stabilitet halter stadig bagefter siliciumbaserede solcellers. Et kinesisk-tysk hold af viden
Organisk farvestof i zinkoxidmellemlag stabiliserer og øger ydeevnen af organiske solcellerKredit:Wiley Organiske solceller er lavet af billige og rigelige materialer, men deres effektivitet og stabilitet halter stadig bagefter siliciumbaserede solcellers. Et kinesisk-tysk hold af viden -
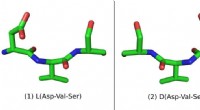 Gennem skueglasset:Nye spejlbillede-molekyler kan føre til bedre medicinDette peptid består af tre aminosyrer:Aspartinsyre (Asp), Valin (Val) og Serine (Ser). Den naturlige L-form er til venstre og den syntetiske D-form er til højre Kredit:Pablo Gainza University of T
Gennem skueglasset:Nye spejlbillede-molekyler kan føre til bedre medicinDette peptid består af tre aminosyrer:Aspartinsyre (Asp), Valin (Val) og Serine (Ser). Den naturlige L-form er til venstre og den syntetiske D-form er til højre Kredit:Pablo Gainza University of T -
 Ny antiviral, antibakteriel overflade kan reducere spredning af infektioner på hospitalerKredit:CC0 Public Domain Den nye coronavirus-pandemi har forårsaget en øget efterspørgsel efter antimikrobielle behandlinger, der kan holde overflader rene, især i sundhedsvæsenet. Selvom der er u
Ny antiviral, antibakteriel overflade kan reducere spredning af infektioner på hospitalerKredit:CC0 Public Domain Den nye coronavirus-pandemi har forårsaget en øget efterspørgsel efter antimikrobielle behandlinger, der kan holde overflader rene, især i sundhedsvæsenet. Selvom der er u
- Hvad er 4 gange afstand fra solen i Wattsm2?
- Bølgede transistorer, der får lodret bredde uden at øge deres aftryk på chip til fremtidige flek…
- Hawaii-teleskopdemonstranter går ikke tilbage efter anholdelser
- Hvor stressede er vi lige, når det kommer til boligoverkommelighed?
- Hvilket grundstof har elektronkonfigurationen 1s22s22p63s2?
- Hvad udøves tyngdekraft på et objekt, der kaldes?


