Når et overgangsmetal reagerer med klor, hvilke typer bindinger dannes mellem de to elementer?
* overgangsmetaller har en tendens til at miste elektroner til dannelse af positivt ladede ioner (kationer). Dette skyldes deres relativt lave ioniseringsenergier og tilstedeværelsen af D-elektroner, der let kan fjernes.
* klor er et meget elektronegativt element, hvilket betyder, at det stærkt tiltrækker elektroner. Det får en elektron til dannelse af en negativt ladet ion (anion), Cl⁻.
Den stærke elektrostatiske tiltrækning mellem den positivt ladede metalkation og den negativt ladede chloridanion resulterer i dannelsen af en ionisk binding.
Eksempel:
Reaktionen af jern (Fe) med klor (CL₂) danner jern (III) chlorid (fecl₃):
2FE (S) + 3Cl₂ (G) → 2FeCl₃ (S)
I fecl₃ findes jern som Fe³⁺ -ioner, og klor findes som Cl⁻ioner, der holdes sammen af ioniske bindinger.
 Varme artikler
Varme artikler
-
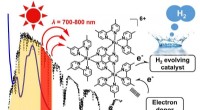 NIR-drevet H2-udvikling fra vand:Udvidet bølgelængdeområde for konvertering af solenergiNær-infrarødt-lysdrevet hydrogenudvikling fra vand fotodrevet af triruthenium fotosensibilisator. Kredit:Kyushu University Hydrogengas er et lovende grønt brændstof. Det letteste kemiske element,
NIR-drevet H2-udvikling fra vand:Udvidet bølgelængdeområde for konvertering af solenergiNær-infrarødt-lysdrevet hydrogenudvikling fra vand fotodrevet af triruthenium fotosensibilisator. Kredit:Kyushu University Hydrogengas er et lovende grønt brændstof. Det letteste kemiske element, -
 Laserbehandling viser potentiale for at reducere industriel kemisk behandling af køretøjerORNL-forsker Adrian Sabau beskriver komponenter i et laserinterferensstruktureringssystem, der blev brugt til at behandle aluminiumslegeringsplader til korrosionsbeskyttelse. Kredit:Carlos Jones/ORNL,
Laserbehandling viser potentiale for at reducere industriel kemisk behandling af køretøjerORNL-forsker Adrian Sabau beskriver komponenter i et laserinterferensstruktureringssystem, der blev brugt til at behandle aluminiumslegeringsplader til korrosionsbeskyttelse. Kredit:Carlos Jones/ORNL, -
 3D-print af korte kulfiber-forstærkede termohærdende polymerkompositterKredit:Colorado State University Den 27 sekunder lange video afspilles i en loop, og den er fascinerende at se:Kulfibermateriale, der vælter ud af en 3D-printer og langsomt hvirvler og stables som
3D-print af korte kulfiber-forstærkede termohærdende polymerkompositterKredit:Colorado State University Den 27 sekunder lange video afspilles i en loop, og den er fascinerende at se:Kulfibermateriale, der vælter ud af en 3D-printer og langsomt hvirvler og stables som -
 Meget elastisk biologisk nedbrydelig hydrogel til bioprint af nyt vævYi Hong, UTA professor i bioteknik og leder af projektet. Kredit:UTA Forskere ved University of Texas i Arlington har udviklet en meget elastisk biologisk nedbrydelig hydrogel til bio-printning af
Meget elastisk biologisk nedbrydelig hydrogel til bioprint af nyt vævYi Hong, UTA professor i bioteknik og leder af projektet. Kredit:UTA Forskere ved University of Texas i Arlington har udviklet en meget elastisk biologisk nedbrydelig hydrogel til bio-printning af
- Hvilket er ikke en måde at udtrykke hydroxid- og hydroniumionkoncentrationerne i rent vand ved 25 C…
- Hvor små vandprøver kan finde virkelig store dyr
- Hvilke genstande kan udstråle energi?
- Hvad er brugen af ørkenjord?
- Hvilken energitransformation er der i en cykel?
- Hvad er potentiel energi, der findes, når et objekt, der er påvirket af denne tyngdekraft og magne…


