Hvad er navnene på partikler, der bærer ladning, når elektricitet strømmer gennem smeltet NaCl og vandig NaCl?
smeltet NaCl:
* opladningsbærere: Natriumioner (Na+) og chloridioner (Cl-)
* Forklaring: Når NaCl smelter, går de ioniske bindinger, og ionerne bliver frie til at bevæge sig. Dette giver dem mulighed for at bære elektrisk strøm.
vandig NaCl (saltvand):
* opladningsbærere: Natriumioner (Na+) og chloridioner (Cl-) samt hydratiserede elektroner (Elektroner omgivet af vandmolekyler).
* Forklaring: I opløsning opløses NaCl i ioner. Ionerne er frie til at bevæge sig og bære strøm. Derudover kan vandmolekyler også deltage i ledning ved at acceptere elektroner og blive hydrerede elektroner.
Nøglepunkter:
* ioniske forbindelser: Det grundlæggende princip er, at elektricitet i ioniske forbindelser (som NaCl) udføres af bevægelsen af ioner.
* hydratiserede elektroner: Tilstedeværelsen af hydratiserede elektroner i vandige opløsninger forbedrer løsningen af opløsningen.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse koncepter!
 Varme artikler
Varme artikler
-
 Naturen giver en køreplan til potentielle gennembrud inden for solenergiteknologiKredit:CC0 Public Domain Efterhånden som politiske beslutningstagere i stigende grad vender sig mod videnskab i forhold til globale klimaændringer, en videnskabsmand fra Michigan State University
Naturen giver en køreplan til potentielle gennembrud inden for solenergiteknologiKredit:CC0 Public Domain Efterhånden som politiske beslutningstagere i stigende grad vender sig mod videnskab i forhold til globale klimaændringer, en videnskabsmand fra Michigan State University -
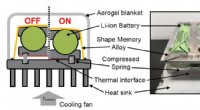 Termiske høreværn beskytter mobiltelefonens batterier mod ekstreme temperaturerDer vises en skematisk og foto af en termisk regulator designet af Berkeley-ingeniører til passivt at holde lithium-ion-batterier inden for et optimalt temperaturområde. Ved højere temperaturer, ledni
Termiske høreværn beskytter mobiltelefonens batterier mod ekstreme temperaturerDer vises en skematisk og foto af en termisk regulator designet af Berkeley-ingeniører til passivt at holde lithium-ion-batterier inden for et optimalt temperaturområde. Ved højere temperaturer, ledni -
 Svævende dråber giver videnskabsmænd mulighed for at udføre berøringsfri kemiske reaktionerLeviterende dråber af sure og basiske opløsninger (venstre) smelter sammen til en større dråbe (højre), hvor der dannes kuldioxidbobler som et produkt af reaktionen. Kredit: Analytisk kemi 2020, DOI:
Svævende dråber giver videnskabsmænd mulighed for at udføre berøringsfri kemiske reaktionerLeviterende dråber af sure og basiske opløsninger (venstre) smelter sammen til en større dråbe (højre), hvor der dannes kuldioxidbobler som et produkt af reaktionen. Kredit: Analytisk kemi 2020, DOI: -
 MOF co-katalysator tillader selektivitet af forgrenede aldehyder på op til 90 %Mikroporer af MOFer med visse topologier øger tætheden af olefinerne, mens de delvist forhindrer adsorptionen af syntesegassen. Kredit:@PSI Bestræbelser på at udvikle heterogene katalysatorer,
MOF co-katalysator tillader selektivitet af forgrenede aldehyder på op til 90 %Mikroporer af MOFer med visse topologier øger tætheden af olefinerne, mens de delvist forhindrer adsorptionen af syntesegassen. Kredit:@PSI Bestræbelser på at udvikle heterogene katalysatorer,
- Teamdetaljer plasmonisk effekt, der gør det muligt for katalysatoren at arbejde med lavere energi
- Hvordan forskere, landmænd og bryggere ønsker at sikre øl mod klimaforandringer
- Beskeden opvarmning risikerer irreversibelt tab af indlandsis, undersøgelse advarer
- Hvilken slags energi bruger et elektronmikroskop?
- Hvem producerer sund energi?
- Hvordan ligner månen andre planeter?


