Hvad er en ligning for reaktionen af aluminiumchlorid med vand?
ALCL₃ (S) + 6H₂O (L) → [AL (H₂O) ₆] ³⁺ (aq) + 3cl⁻ (aq)
Forklaring:
* alcl₃ (s): Aluminiumchlorid er et fast stof i sin vandfri form.
* h₂o (l): Vand er en væske.
* [al (h₂o) ₆] ³⁺ (aq): Aluminium danner en kompleks ion med seks vandmolekyler, [Al (H₂O) ₆] ³⁺, i opløsning. Denne komplekse ion forenkles ofte til al³⁺ (aq).
* 3Cl⁻ (aq): Chloridionerne frigøres i opløsningen.
Nøglepunkter:
* Hydrolyse: Reaktionen involverer vandmolekyler, der bryder aluminiumchloridforbindelsen.
* eksotermisk: Denne reaktion er eksoterm, hvilket betyder, at den frigiver varme.
* sur opløsning: Opløsningen bliver sur på grund af dannelsen af hydroniumioner (H₃O⁺) fra hydrolyse af ALCL₃.
Bemærk: Reaktionen er reversibel, men den fremadrettede reaktion foretrækkes i dette tilfælde.
 Varme artikler
Varme artikler
-
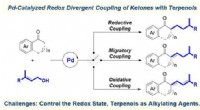 Ny strategi udviklet til redox divergerende kobling af ketoner med terpenerPd-katalyseret redox divergerende kobling af ketoner med terpenoler. Kredit:ZHAO Chaoyang Hydrogenering og dehydrogenering er to vigtige kunstige metoder til at ændre redoxtilstanden af forbinde
Ny strategi udviklet til redox divergerende kobling af ketoner med terpenerPd-katalyseret redox divergerende kobling af ketoner med terpenoler. Kredit:ZHAO Chaoyang Hydrogenering og dehydrogenering er to vigtige kunstige metoder til at ændre redoxtilstanden af forbinde -
 Ny membran kunne bane vej for billigt, effektivt fremstillede biobrændstofferDe forskellige typer biobrændstofmembraner. Kredit:Imperial College London Forskere har udviklet en omkostningseffektiv metode til udvinding af biobrændstof, som kan gøre dem til levedygtige alter
Ny membran kunne bane vej for billigt, effektivt fremstillede biobrændstofferDe forskellige typer biobrændstofmembraner. Kredit:Imperial College London Forskere har udviklet en omkostningseffektiv metode til udvinding af biobrændstof, som kan gøre dem til levedygtige alter -
 Elektrokemi åbner ny adgang til vigtige klasser af stofferEn ung forsker i professor Waldvogels team, der bruger et screeningsapparat til parallel elektrolyseoptimering. Kredit:Alexander Sell Elektrokemi har gennemgået en renæssance i de seneste år, og m
Elektrokemi åbner ny adgang til vigtige klasser af stofferEn ung forsker i professor Waldvogels team, der bruger et screeningsapparat til parallel elektrolyseoptimering. Kredit:Alexander Sell Elektrokemi har gennemgået en renæssance i de seneste år, og m -
 Ny klasse katalysatorer til energiomsætningMichael Meischein foran sprutsystemet, hvor nanopartikler fremstilles ved co-deponering i en ionisk væske Kredit:RUB, Marquard Mange kemiske reaktioner, der er relevante for nye energikilder, er m
Ny klasse katalysatorer til energiomsætningMichael Meischein foran sprutsystemet, hvor nanopartikler fremstilles ved co-deponering i en ionisk væske Kredit:RUB, Marquard Mange kemiske reaktioner, der er relevante for nye energikilder, er m
- Hvordan videnskabsmænd opdagede vores første interstellare mystiske besøgende
- Uber medicin levering til kræftpatienter
- Hvad er ladningen på monatomisk ion, som calcium dannes i dens forbindelser?
- Mænd bruger ofte homofobiske tweets for at beskytte maskulinitet, undersøgelsesfund (artikel indeh…
- Samsung Electronics forventer stigning i overskuddet på efterspørgsel efter coronavirus
- 5, 200 år gamle korn i de østlige Altai-bjerge fornyer trans-eurasisk afgrødeudveksling


