Hvad sker der så et natriumatom og klori udveksler en elektron?
* natrium (NA) Har en elektron i sin yderste skal. Det mister let dette elektron for at opnå en stabil, fuld ydre skal.
* klor (Cl) Har syv elektroner i sin yderste skal. Det har brug for endnu en elektron for at opnå en stabil, fuld ydre skal.
Udvekslingen:
1. Natrium mister sin enkelt valenselektron og bliver en positivt ladet ion kaldet en natriumkation (Na+) .
2. klor får denne elektron og bliver en negativt ladet ion kaldet A chloridanion (Cl-) .
ionisk bindingsdannelse:
De modsatte ladninger af natriumkationen og chloridanionen tiltrækker hinanden stærkt og danner en ionisk binding. Denne elektrostatiske attraktion holder ionerne sammen i en krystalgitterstruktur og danner natriumchlorid.
Nøglepunkter:
* ioniske bindinger dannes mellem metaller (som natrium) og ikke -metaller (som klor).
* Overførslen af elektroner resulterer i dannelsen af ladede ioner (kationer og anioner).
* Den elektrostatiske tiltrækning mellem modsat ladede ioner er det, der holder forbindelsen sammen.
* Natriumchlorid er et klassisk eksempel på en ionisk forbindelse, og dets dannelse gennem elektronoverførsel er et grundlæggende koncept inden for kemi.
 Varme artikler
Varme artikler
-
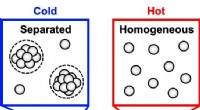 Ny model beskriver faseseparation, der ødelægger antistofopløsningerEn ny undersøgelse brugte en temperaturgradient til at observere, hvor stærkt koncentrerede antistofopløsninger, som dem, der er almindelige i nogle lægemidler, opdelt i faser, som en olie- og vandopl
Ny model beskriver faseseparation, der ødelægger antistofopløsningerEn ny undersøgelse brugte en temperaturgradient til at observere, hvor stærkt koncentrerede antistofopløsninger, som dem, der er almindelige i nogle lægemidler, opdelt i faser, som en olie- og vandopl -
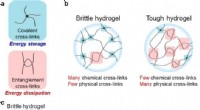 En universel metode til nemt at designe seje og strækbare hydrogelerSkema af hydrogeler med fysiske og kemiske tværbindinger. (a) Kovalente og sammenfiltrede tværbindinger til energilagring og -dissipation, henholdsvis. (b) Kemisk og fysisk tværbundne strukturer af sk
En universel metode til nemt at designe seje og strækbare hydrogelerSkema af hydrogeler med fysiske og kemiske tværbindinger. (a) Kovalente og sammenfiltrede tværbindinger til energilagring og -dissipation, henholdsvis. (b) Kemisk og fysisk tværbundne strukturer af sk -
 Forskere opfinder små, genlukkelige pakker til levering af materialer i køDenne simulering viser lagene i pakkerne - et sort ydre lag, en rød, udskifteligt lag, der forbinder de to, og det glasagtige inderlag i guld. Blå vandmolekyler omgiver pakken. Kredit:Lucas Antony
Forskere opfinder små, genlukkelige pakker til levering af materialer i køDenne simulering viser lagene i pakkerne - et sort ydre lag, en rød, udskifteligt lag, der forbinder de to, og det glasagtige inderlag i guld. Blå vandmolekyler omgiver pakken. Kredit:Lucas Antony -
 Fra identifikation til et kemisk fingeraftryk for sprængstoffer i retsmedicinsk forskningCobra fyrværkeri. Kredit:Karlijn Bezemer Politiet støder ofte på sprængstoffer i deres retsmedicinske efterforskninger relateret til kriminelle og terroraktiviteter. Kemisk analyse af sprængstoffe
Fra identifikation til et kemisk fingeraftryk for sprængstoffer i retsmedicinsk forskningCobra fyrværkeri. Kredit:Karlijn Bezemer Politiet støder ofte på sprængstoffer i deres retsmedicinske efterforskninger relateret til kriminelle og terroraktiviteter. Kemisk analyse af sprængstoffe
- Kraniescanninger fortæller historien om, hvordan verdens første hunde fangede deres bytte
- Æblers skattefradrag giver aktionærerne en velsignelse på 102 milliarder dollars
- Kun 57 producenter er ansvarlige for 80 % af alle fossile brændstoffer og cement CO₂-emissioner sid…
- Hvad er en videnskabelig bestræbelse?
- Sådan kortslutter man ikke overgangen til ren energi
- Hvorfor bruger astronomer deklination og ret opstigning?


