For den kemiske reaktion er H2 CO2-H20 CO-energi indeholdt i reaktanter 352 kJ og produkter 394 Antagende, at 1 mol af hvert stof præsenterer dette sandt?
* Den reaktion, du har beskrevet, er forbrænding af brint med kuldioxid: H₂ + CO₂ → H₂O + CO
* forbrændingsreaktioner er eksoterme: Dette betyder, at de frigiver energi i omgivelserne. Reaktanternes energiindhold er * højere * end energiindholdet i produkterne.
Derfor bør reaktanternes energiindhold (H₂ og CO₂) være højere end energiindholdet i produkterne (H₂O og CO).
Lad os se på et mere realistisk eksempel:
Forbrændingen af methan (CH₄) med ilt (O₂) til fremstilling af kuldioxid (CO₂) og vand (H₂O) er en velkendt eksoterm reaktion.
* ch₄ + 2o₂ → CO₂ + 2H₂O
I dette tilfælde er reaktanternes energiindhold (ch₄ og o₂) faktisk højere end energiindholdet i produkterne (CO₂ og H₂O). Denne energiforskel frigives som varme og lys under forbrændingsprocessen.
Nøglepunkt: Eksoterme reaktioner har en negativ enthalpi -ændring (ΔH <0), hvilket indikerer, at energi frigøres.
 Varme artikler
Varme artikler
-
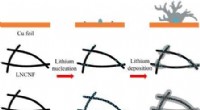 En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science
En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science -
 Forskere producerer omkostningseffektive, miljøvenligt glasmaterialeKomplekse strukturer af transparent smeltet silica fremstillet via sprøjtestøbning af den nyudviklede Glassomer-komposit. Kredit:Glassomer GmbH Glas er allestedsnærværende i højteknologiske produk
Forskere producerer omkostningseffektive, miljøvenligt glasmaterialeKomplekse strukturer af transparent smeltet silica fremstillet via sprøjtestøbning af den nyudviklede Glassomer-komposit. Kredit:Glassomer GmbH Glas er allestedsnærværende i højteknologiske produk -
 Ny 3D-udskrivningsmetode kan transformere materiale bag vital medicinsk isotopLaboratoriets nye 3D-udskrivningstilgang gør sin genbrugsmetode-banebrydende i 2015 af Mo-99-programchef Peter Tkac (til venstre) og andre-hurtigere, mere pålidelig, og mere omkostningseffektivt. Også
Ny 3D-udskrivningsmetode kan transformere materiale bag vital medicinsk isotopLaboratoriets nye 3D-udskrivningstilgang gør sin genbrugsmetode-banebrydende i 2015 af Mo-99-programchef Peter Tkac (til venstre) og andre-hurtigere, mere pålidelig, og mere omkostningseffektivt. Også -
 En plastikfilm, der kan dræbe vira ved hjælp af rumlysGrafisk abstrakt. Kredit:Journal of Photochemistry and Photobiology B:Biology (2022). DOI:10.1016/j.jphotobiol.2022.112551 Forskere ved Queens University Belfast har udviklet en plastikfilm, der ka
En plastikfilm, der kan dræbe vira ved hjælp af rumlysGrafisk abstrakt. Kredit:Journal of Photochemistry and Photobiology B:Biology (2022). DOI:10.1016/j.jphotobiol.2022.112551 Forskere ved Queens University Belfast har udviklet en plastikfilm, der ka
- Landskabsmarkedet har en kategori for ethvert aktivitetsniveau
- Et lag af sedimentær sten er 2 meter tyk, hvor mange år tog det for dette at dannes, hvis der er e…
- Har en boldrulling kinetisk energi?
- Hvis du kender tætheden og volumenet af et stof, hvordan kunne det finde dets masse?
- Afkodning af, hvordan børn begynder at hacke
- Forskere efterlyser et rigtigt billede af vold i hjemmet


