Hvad er lignende kemiske egenskaber, der tilskrives?
* Valenselektroner: Dette er elektronerne i den yderste skal af et atom. Det er dem, der er involveret i kemisk binding, og bestemmer, hvordan et element interagerer med andre elementer.
* Elektronkonfiguration: Fordelingen af elektroner i energiniveauer og underniveauer inden for et atom. Elementer med lignende elektronkonfigurationer, især i deres valensskaller, udviser lignende kemisk opførsel.
Her er, hvordan lignende elektronkonfigurationer fører til lignende egenskaber:
* Lignende reaktivitet: Elementer med det samme antal valenselektroner har en tendens til at danne lignende typer bindinger og deltage i lignende kemiske reaktioner. For eksempel har alle alkalimetaller (Li, Na, K, RB, CS, FR) en valenselektron, hvilket gør dem meget reaktive og tilbøjelige til at miste denne elektron til dannelse af en +1 -ion.
* Lignende bindingsmønstre: Elementer med lignende valenselektronkonfigurationer har en tendens til at danne de samme typer bindinger (ioniske, kovalente, metalliske). For eksempel har halogener (F, CL, Br, I, AT) alle syv valenselektroner og får let et elektron til dannelse af en -1 -ion.
* Lignende oxidation siger: Elementer med lignende elektronkonfigurationer udviser ofte lignende oxidationstilstande, hvilket afspejler deres tendens til at vinde eller miste elektroner. For eksempel har overgangsmetaller i den samme gruppe en tendens til at udvise lignende oxidationstilstande på grund af deres lignende D-elektronkonfigurationer.
Det er vigtigt at bemærke:
* Periodiske tendenser: Den periodiske tabel organiserer elementer baseret på deres elektronkonfigurationer og lignende kemiske egenskaber observeres inden for grupper (kolonner) og perioder (rækker). Dette giver os mulighed for at forudsige egenskaberne ved elementer baseret på deres position på bordet.
* Undtagelser: Mens elektronkonfiguration er en primær faktor, er der nogle undtagelser. Faktorer som størrelsen på atomet, elektronegativitet og atomafgift kan også påvirke kemisk opførsel.
Afslutningsvis er lignende elektronkonfigurationer, især i valensskallen, hovedårsagen til, at elementer udviser lignende kemiske egenskaber. Denne forståelse er grundlæggende for at forstå kemisk reaktivitet, binding og opførsel af elementer i forskellige reaktioner og forbindelser.
Sidste artikelHvilken type binding gør fosfor og svovl?
Næste artikelHvad er hydroxid lavet af?
 Varme artikler
Varme artikler
-
 Forskere finder potentiale i miljøvenlig synthesizerDisse rombeformede partikler scanner elektronmikrofotografier af en organisk metalramme, kaldet ZIF-8, syntetiseret i superkritisk kuldioxid (scCO2). PNNL -forskere har rapporteret, at scCO2, et vigti
Forskere finder potentiale i miljøvenlig synthesizerDisse rombeformede partikler scanner elektronmikrofotografier af en organisk metalramme, kaldet ZIF-8, syntetiseret i superkritisk kuldioxid (scCO2). PNNL -forskere har rapporteret, at scCO2, et vigti -
 Reparation af aktivt pumpende hjertevæv med muslinge-inspireret vævsklæberInspireret af Moder Natur:Havmuslinger modstår let de stormfulde brændinger. De holder på overfladen med proteintråde. Empa-forskere bruger denne egenskab til en ny vævslim til sårbehandling. Kredit:P
Reparation af aktivt pumpende hjertevæv med muslinge-inspireret vævsklæberInspireret af Moder Natur:Havmuslinger modstår let de stormfulde brændinger. De holder på overfladen med proteintråde. Empa-forskere bruger denne egenskab til en ny vævslim til sårbehandling. Kredit:P -
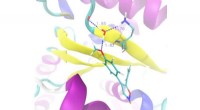 Forskere opdager nyt anti-cancer molekyleSnapshot fra simulering af molekylær dynamik af forbindelse 2c bundet til tubulin. Et system af hydrogenbindinger blev dannet, der involverer liganden, proteinresterne Asn349 og Lys352 og et vandmolek
Forskere opdager nyt anti-cancer molekyleSnapshot fra simulering af molekylær dynamik af forbindelse 2c bundet til tubulin. Et system af hydrogenbindinger blev dannet, der involverer liganden, proteinresterne Asn349 og Lys352 og et vandmolek -
 Zink regulerer lagring og frigivelse af neurotransmittereZink er et vigtigt mikronæringsstof involveret i mange cellulære processer:F.eks. i lærings- og hukommelsesprocesser, det spiller en rolle, som endnu ikke er forstået. Ved at bruge nanoelektrokemiske
Zink regulerer lagring og frigivelse af neurotransmittereZink er et vigtigt mikronæringsstof involveret i mange cellulære processer:F.eks. i lærings- og hukommelsesprocesser, det spiller en rolle, som endnu ikke er forstået. Ved at bruge nanoelektrokemiske
- Hvor mange jordtimer er der i 14 Martian -dage?
- Støv hjælper med at regulere Sierra Nevadas økosystemer, undersøgelse finder
- Hvilke to variabler dikterer, hvor meget tyngdekraft på et objekt har på et andet objekt?
- Hvad er den tidligste fase i en stjernelivscyklus?
- Kan energi til at arbejde en generator komme fra bølger og tidevand?
- Hvilken type binding vil være form mellem svovl- og kloratomer?


