Hvilken type binding gør fosfor og svovl?
Her er hvorfor:
* Elektronegativitet: Fosfor og svovl har relativt ens elektronegativitetsværdier. Dette betyder, at de har en lignende evne til at tiltrække elektroner.
* Deling af elektroner: I stedet for det ene atom, der helt tager et elektron fra den anden (ionisk binding), deler fosfor og svovlelektroner for at opnå en stabil elektronkonfiguration.
Eksempler på forbindelser:
* phosphor pentasulfid (p₂s₅): Denne forbindelse har kovalente bindinger mellem fosfor og svovlatomer.
* fosfor sesquisulfid (p₄s₃): En anden forbindelse med kovalente bindinger mellem fosfor og svovl.
Bemærk: Mens bindingen generelt betragtes som kovalent, kan der være en let polær karakter på grund af den lille forskel i elektronegativitet mellem fosfor og svovl.
 Varme artikler
Varme artikler
-
 Metalsæber er kritiske i hastigheden af forringelse af oliemalerierJohannes Vermeer, Udsigt over Delft, c. 1660 - 1661. Kredit:Mauritshuis, Haag Et oliemaleri er ikke et permanent og uforanderligt objekt, men gennemgår en meget langsom forandring i den ydre og in
Metalsæber er kritiske i hastigheden af forringelse af oliemalerierJohannes Vermeer, Udsigt over Delft, c. 1660 - 1661. Kredit:Mauritshuis, Haag Et oliemaleri er ikke et permanent og uforanderligt objekt, men gennemgår en meget langsom forandring i den ydre og in -
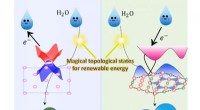 Fremskynde brintproduktionen ved hjælp af de magiske topologiske overfladetilstandeTopologiske ikke-trivielle overfladetilstande kan acceptere eller donere elektroner under vandelektrolyseprocessen. Kredit:MPI CPfS Brintøkonomien anses for at være en af de bedste muligheder fo
Fremskynde brintproduktionen ved hjælp af de magiske topologiske overfladetilstandeTopologiske ikke-trivielle overfladetilstande kan acceptere eller donere elektroner under vandelektrolyseprocessen. Kredit:MPI CPfS Brintøkonomien anses for at være en af de bedste muligheder fo -
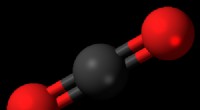 Forsker undersøger, hvordan man konverterer kuldioxid til byggestenene til brændstofBall-and-stick model af kuldioxid. Kredit:Wikipedia At opdele de kemiske bindinger i CO2 molekyler, er der brug for varme. En måde at få denne varme på er fra plasmaer, og det har længe været kendt
Forsker undersøger, hvordan man konverterer kuldioxid til byggestenene til brændstofBall-and-stick model af kuldioxid. Kredit:Wikipedia At opdele de kemiske bindinger i CO2 molekyler, er der brug for varme. En måde at få denne varme på er fra plasmaer, og det har længe været kendt -
 Elektronisk signal udvider materialet med en faktor på 100Eleni Stavrinidou, Johannes Gladisch og Magnus Berggren med det nye materiale. Kredit:Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköping Universitet, har opdaget et materiale,
Elektronisk signal udvider materialet med en faktor på 100Eleni Stavrinidou, Johannes Gladisch og Magnus Berggren med det nye materiale. Kredit:Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköping Universitet, har opdaget et materiale,
- Hvor mange mennesker har været Mars?
- Luftbåren radar afslører grundvand under gletsjeren
- Undersøgelse finder fluor som mulig erstatning for lithium i genopladelige batterier
- Er elementer den bedste leder af elektricitet?
- Hvad 3 rumhåndværk har udforsket Mars?
- Er mindre mere? Sådan ser forbrugerne på bæredygtighedskrav


