Hvad har den mest metalliske karakter fluorklorbrom eller jod?
Her er hvorfor:
* Metallisk karakter øges ned en gruppe i den periodiske tabel. Dette skyldes, at når du går ned ad en gruppe, øges atomradius, og de yderste elektroner er længere væk fra kernen. Dette resulterer i svagere tiltrækning mellem kernen og valenselektronerne, hvilket gør dem lettere at miste og udvise metalliske egenskaber.
* fluor, klor og brom er alle halogener , som er ikke -metaller. Imidlertid sidder jod under dem i den samme gruppe og udviser flere metalliske egenskaber på grund af de ovennævnte grunde.
Mens jod stadig betragtes som en ikke -metal, viser det nogle egenskaber, der er mere typiske for metaller, såsom:
* Evne til at danne kationer: Jod kan danne positive ioner (kationer) i nogle forbindelser.
* Lustrøst udseende: Solid jod har et skinnende, metallisk lignende udseende.
* Konduktivitet: Jod kan udføre elektricitet i lille grad.
Fortæl mig, hvis du har andre kemi -spørgsmål!
Sidste artikelHvad dannes, når grundvand blandes med kuldioxid fra luft?
Næste artikelHvad er forholdet mellem zink og klor i chlorid?
 Varme artikler
Varme artikler
-
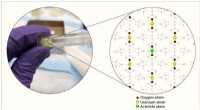 Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk
Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk -
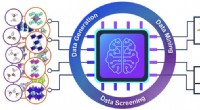 Datavidenskab hjælper ingeniører med at opdage nye materialer til solceller og LED'erSkematisk illustration af arbejdsgangen for high-throughput design af organisk-uorganisk hybrid halogenid-halvledere til solceller og lysdioder. Kredit:Yang lab/Energy &Environmental Science Ingen
Datavidenskab hjælper ingeniører med at opdage nye materialer til solceller og LED'erSkematisk illustration af arbejdsgangen for high-throughput design af organisk-uorganisk hybrid halogenid-halvledere til solceller og lysdioder. Kredit:Yang lab/Energy &Environmental Science Ingen -
 Computermodel afslører effekten af øget kolesterol på specifik ionkanal i hjertetSet ovenfra og ned af den åbne Kir2-kaliumkanal, fremhæver den pore, som ioner bevæger sig igennem. Kredit:Nicolas Barbera Ved hjælp af en computermodel, forskere fra North Carolina State Universi
Computermodel afslører effekten af øget kolesterol på specifik ionkanal i hjertetSet ovenfra og ned af den åbne Kir2-kaliumkanal, fremhæver den pore, som ioner bevæger sig igennem. Kredit:Nicolas Barbera Ved hjælp af en computermodel, forskere fra North Carolina State Universi -
 Bryde CH-bindingerne i kulbrinter for at syntetisere komplekse organiske molekylerKredit:Pixabay/CC0 Public Domain Kulstof-hydrogen-bindingerne i alkaner - især dem i enderne af molekylerne, hvor hvert kulstof har tre brintatomer bundet til sig - er meget svære at knække, hvis
Bryde CH-bindingerne i kulbrinter for at syntetisere komplekse organiske molekylerKredit:Pixabay/CC0 Public Domain Kulstof-hydrogen-bindingerne i alkaner - især dem i enderne af molekylerne, hvor hvert kulstof har tre brintatomer bundet til sig - er meget svære at knække, hvis
- Forskere finder sammenhæng mellem vigtige planteaminosyrer og essentielle hormoner
- Hvilken anvendelse er det at kende slags vækstmønster på en agar -skrå eller en bouillon medium …
- Hvad er Jorden for det meste lavet?
- Forskere afslører oprindelsen af Oobleck-bølger
- Hvad gør solenergi til en nyttig kilde?
- Newton viste, at love er?


