Hvad sker der, når der tilsættes aluminium til vand og kobberchlorid?
* aluminium er mere reaktiv end kobber. Aluminium er højere på reaktivitetsserien end kobber. Dette betyder, at det har en stærkere tendens til at miste elektroner.
* aluminium fortrænger kobber. Aluminiumatomerne reagerer med kobberchloridet, donerer elektroner til kobberioner (Cu²⁺) og danner aluminiumchlorid (ALCL₃). Kobberionerne får elektroner og reduceres til kobbermetal (Cu).
* Synlige ændringer: Du vil observere flere ændringer:
* Løsningen vil blive en grønlig farve Når kobberchlorid er brugt op, og aluminiumchlorid dannes.
* Et rødbrunt bundfald af kobbermetal danner i bunden af beholderen.
* Aluminiumsmetallet begynder at opløses når det bliver oxideret.
Her er den kemiske ligning for reaktionen:
2 Al (s) + 3 cucl₂ (aq) → 2 alcl₃ (aq) + 3 cu (s)
Kortfattet:
* Aluminium reagerer med kobberchlorid.
* Aluminium erstatter kobber i opløsningen.
* Kobbermetal udfælder ud af opløsningen.
* Aluminiumchloridformer i opløsningen.
Sidste artikelEr natrium og nitrogen en molekylær forbindelse?
Næste artikelI hvor mange mol er 8,37 gange 10 effekt 23 molekyler N2?
 Varme artikler
Varme artikler
-
 Ny teknologi omdanner biomasse til kulKredit:University of Nottingham University of Nottingham samarbejder med Energy Research Accelerator (ERA) og CPL Industries om at producere en kommerciel anlæg, der er i stand til at omdanne biom
Ny teknologi omdanner biomasse til kulKredit:University of Nottingham University of Nottingham samarbejder med Energy Research Accelerator (ERA) og CPL Industries om at producere en kommerciel anlæg, der er i stand til at omdanne biom -
 En miljøvenlig, lavprisløsning til spildevandsrensningKredit:somsak nitimongkolchai, Shutterstock Forskere udviklede et bæredygtigt spildevandsbehandlingssystem lavet af landbrugs- og industriaffald. Ifølge FNs skøn, to tredjedele af verdens befolkn
En miljøvenlig, lavprisløsning til spildevandsrensningKredit:somsak nitimongkolchai, Shutterstock Forskere udviklede et bæredygtigt spildevandsbehandlingssystem lavet af landbrugs- og industriaffald. Ifølge FNs skøn, to tredjedele af verdens befolkn -
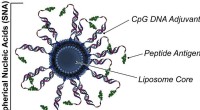 Vaccinedesign kan dramatisk forbedre kræftimmunoterapierDen mest succesfulde sfæriske nukleinsyre (SNA) i kræftimmunoterapivaccinen fik peptidantigenet spækket med DNA. Kredit:Shuya Wang/Northwestern University Når det kommer til effektiviteten af na
Vaccinedesign kan dramatisk forbedre kræftimmunoterapierDen mest succesfulde sfæriske nukleinsyre (SNA) i kræftimmunoterapivaccinen fik peptidantigenet spækket med DNA. Kredit:Shuya Wang/Northwestern University Når det kommer til effektiviteten af na -
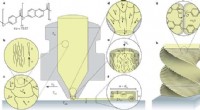 3D-udskrivning hierarkiske flydende krystal-polymerstrukturerUdskrivning af hierarkiske termotrope LCPer ved hjælp af fusioneret deponeringsmodellering. a) korte stavlignende polymerkæder dannet af en aromatisk tilfældig copolymer bestående af de stive monomere
3D-udskrivning hierarkiske flydende krystal-polymerstrukturerUdskrivning af hierarkiske termotrope LCPer ved hjælp af fusioneret deponeringsmodellering. a) korte stavlignende polymerkæder dannet af en aromatisk tilfældig copolymer bestående af de stive monomere
- Hvad er en grundlæggende bestanddel af protein?
- Hvad er krav på videnskabelig metode?
- Kina hylder Trumps ZTE olivengren før handelsforhandlinger
- At holde sig i bevægelse - flade orme kaster lys over migrerende stamcellers rolle i kræft
- Hvordan relaterer aktiveringsenergi til cellemetabolismen?
- Hvorfor falder opløseligheden af calciumchromat med stigning i temperaturen?


