Hvorfor calciumchlorid udfører elektricitet som et fast stof?
* ioniske forbindelser: Calciumchlorid er en ionisk forbindelse. Dette betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede calciumioner (Ca²⁺) og negativt ladede chloridioner (CL⁻).
* Krystalgitter: I sin solide tilstand danner cacl₂ en krystallinsk struktur. Ionerne er arrangeret i en meget ordnet, tredimensionel gitter.
* faste positioner: Ionerne holdes fast i disse positioner af stærke elektrostatiske kræfter. De er ikke fri til at flytte.
For et stof til at udføre elektricitet, har det brug for gratis ladningsselskaber. I faste stoffer er disse bærere normalt elektroner. Da ionerne i calciumchlorid er låst på plads, kan de ikke bære elektrisk strøm.
hvorfor cacl₂ opfører sig i opløsning eller når smeltet:
* opløste: Når cacl₂ opløses i vand, går de ioniske bindinger. Ionerne bliver omgivet af vandmolekyler (hydrering) og er fri til at bevæge sig. Dette giver dem mulighed for at bære elektrisk strøm.
* smeltning: Tilsvarende, når cacl₂ smelter, holdes ionerne ikke længere i et fast gitter. De kan bevæge sig frit og fungere som ladningsbærere, så det smeltede salt kan udføre elektricitet.
I resuméet udfører calciumchlorid elektricitet, når dets ioner er fri til at bevæge sig, enten i en opløsning eller når den er smeltet. I sin solide tilstand er ionerne låst i en krystalgitter og kan ikke bære elektrisk strøm.
Sidste artikelTemperaturen, hvormed vand vil ændre sig fra et fast stof til væske?
Næste artikelHvilke 2 metaller består kernen af?
 Varme artikler
Varme artikler
-
 Førsteklasses YEATS-hæmmere, der viser løfte om leukæmibehandlingDr. Xiang David Li og hans forskningsgruppe ved HKU Institut for Kemi. Kredit:@The University of Hong Kong Et forskerhold ledet af Dr. Xiang David Li fra Institut for Kemi ved University of Hong K
Førsteklasses YEATS-hæmmere, der viser løfte om leukæmibehandlingDr. Xiang David Li og hans forskningsgruppe ved HKU Institut for Kemi. Kredit:@The University of Hong Kong Et forskerhold ledet af Dr. Xiang David Li fra Institut for Kemi ved University of Hong K -
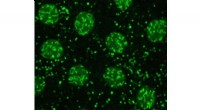 Lipiddråber spiller afgørende roller ud over fedtopbevaringForskerne brugte avanceret fluorescensmikroskopi til at se lipiddråber i frugtflueembryoner. Her, H2Av (fluoresceret i grønt) er til stede i cellens kerner (de store klatter) og på lipiddråber (de min
Lipiddråber spiller afgørende roller ud over fedtopbevaringForskerne brugte avanceret fluorescensmikroskopi til at se lipiddråber i frugtflueembryoner. Her, H2Av (fluoresceret i grønt) er til stede i cellens kerner (de store klatter) og på lipiddråber (de min -
 Stikkende smagsstof i ingefær reducerer dårlig åndeKredit:CC0 Public Domain Den skarpe forbindelse 6-gingerol, en bestanddel af ingefær, stimulerer et enzym i spyt, der nedbryder ildelugtende stoffer. Det sikrer dermed frisk ånde og en bedre efter
Stikkende smagsstof i ingefær reducerer dårlig åndeKredit:CC0 Public Domain Den skarpe forbindelse 6-gingerol, en bestanddel af ingefær, stimulerer et enzym i spyt, der nedbryder ildelugtende stoffer. Det sikrer dermed frisk ånde og en bedre efter -
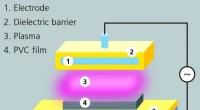 Plasmabehandling reducerer migration af blødgørere fra blodposerEksperimentel samling til DBD (dielektrisk barriereudladning) behandling af PVC-film. Kredit:Fraunhofer IST Medicinske produkter som blodposer og slanger er ofte fremstillet af blød PVC, en plasti
Plasmabehandling reducerer migration af blødgørere fra blodposerEksperimentel samling til DBD (dielektrisk barriereudladning) behandling af PVC-film. Kredit:Fraunhofer IST Medicinske produkter som blodposer og slanger er ofte fremstillet af blød PVC, en plasti
- Hvad er hastigheden, hvis den internationale rumstation i kredsløb pr. Time?
- På hvilke måder svarer blomster til det reproduktive organ hos dyr?
- NASA ser på tropisk depression Kalmaegis vanddampkoncentration
- Hvad er stjernerne i Cassiopeia?
- Hvilken planet blev næsten en anden sol?
- Nanopartikler fyldt med komponent af almindeligt krydderi dræber kræftceller


