Hvad er et kovalent oxid?
Her er en sammenbrud:
Nøglefunktioner:
* Ikke-metalbinding: Kovalente oxider dannes mellem ilt og et ikke-metalelement. Eksempler på ikke-metaler inkluderer kulstof, nitrogen, fosfor, svovl, klor og brom.
* kovalent binding: Bindingen mellem ilt og ikke-metal er en kovalent binding, hvilket betyder, at elektroner deles mellem atomerne.
* molekylær struktur: Kovalente oxider findes typisk som diskrete molekyler med veldefinerede strukturer.
* Varierede egenskaber: Egenskaberne ved kovalente oxider kan variere afhængigt af den involverede ikke-metal. Nogle eksempler inkluderer:
* kuldioxid (CO2): En farveløs gas ved stuetemperatur.
* svovldioxid (SO2): En skarp gas med en kvælende lugt.
* nitrogendioxid (NO2): En giftig rødbrun gas.
* vand (H2O): En væske ved stuetemperatur.
Eksempler:
* CO2 (kuldioxid)
* SO2 (svovldioxid)
* NO2 (nitrogendioxid)
* N2O (nitrogenoxid)
* P2O5 (phosphor pentoxid)
Kontrast med ioniske oxider:
Ionoxider dannes derimod mellem ilt og et metalelement. De dannes ved overførsel af elektroner, hvilket fører til ioniske bindinger.
Betydning:
Kovalente oxider spiller betydelige roller på forskellige felter:
* Miljøkemi: De er involveret i atmosfæriske processer som sur regn og klimaændringer.
* Industriel kemi: De bruges i forskellige industrielle processer, såsom produktion af svovlsyre og salpetersyre.
* biologi: Vand, et kovalent oxid, er vigtigt for livet.
Husk, at det er vigtigt at forstå arten af kovalente oxider for at forstå kemiske reaktioner og deres implikationer på forskellige områder.
Sidste artikelHvorfor er klor og brom en kovalent binding?
Næste artikelHvilken gas har den højere opløselighed CO2 eller O2?
 Varme artikler
Varme artikler
-
 Simulerer manglende evne til at finde styrken i kompositterOptisk billede af et kompositlaminat, der blev brugt i de tværgående fejleksperimenter. Til højre:Repræsentativt billede af en tværgående revne, der spænder over det 90 lag. Som det fremgår af dette o
Simulerer manglende evne til at finde styrken i kompositterOptisk billede af et kompositlaminat, der blev brugt i de tværgående fejleksperimenter. Til højre:Repræsentativt billede af en tværgående revne, der spænder over det 90 lag. Som det fremgår af dette o -
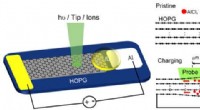 Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoderSkematisk af Al/HOPG planar batteri. Kredit:@Science China Press Overflade og grænseflade spiller en afgørende rolle i energilagringsenheder, kræver derfor in-situ/operando-metoder til at sonde de
Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoderSkematisk af Al/HOPG planar batteri. Kredit:@Science China Press Overflade og grænseflade spiller en afgørende rolle i energilagringsenheder, kræver derfor in-situ/operando-metoder til at sonde de -
 Forskere belyser krystalstrukturen af natriumboridSkoltech Professor Artem Oganov Kredit:Skoltech Et internationalt hold af videnskabsmænd sammen med professor Artem Oganov fra Skoltech og Moskva Institut for Fysik og Teknologi rapporterer om den
Forskere belyser krystalstrukturen af natriumboridSkoltech Professor Artem Oganov Kredit:Skoltech Et internationalt hold af videnskabsmænd sammen med professor Artem Oganov fra Skoltech og Moskva Institut for Fysik og Teknologi rapporterer om den -
 Nyt AI-værktøj beregner materialespænding og -belastning baseret på fotosMIT-forskere har udviklet en maskinlæringsteknik, der bruger et billede af materialets indre struktur til at estimere de spændinger og belastninger, der virker på materialet. Kredit:Massachusetts Inst
Nyt AI-værktøj beregner materialespænding og -belastning baseret på fotosMIT-forskere har udviklet en maskinlæringsteknik, der bruger et billede af materialets indre struktur til at estimere de spændinger og belastninger, der virker på materialet. Kredit:Massachusetts Inst
- Hvorfor har antallet af stjerner ændret sig?
- Kan du bevæge dig rundt med nul tyngdekraft?
- Twitter flytter for at begrænse manipuleret indhold, herunder deepfakes
- Hvordan digitale teknologier kan hjælpe Afrikas småbønder
- Washington states omsætningsafgiftsfradrag for elektriske køretøjer ophører
- Hvad er et kovalent bånd?


