Hvorfor er klor og brom en kovalent binding?
* ikke -metaller: Ikke -metaller har generelt en stærk tendens til at få elektroner for at opnå en stabil elektronkonfiguration. Det er sandsynligvis ikke let at miste elektroner.
* Lignende elektronegativitet: Elektronegativitet er målet for et atoms evne til at tiltrække elektroner i en binding. Klor og brom har lignende elektronegativitetsværdier, hvilket betyder, at de har en lignende attraktion for elektroner.
Når to ikke -metaller med lignende elektronegativitetsværdier er bond, er hverken atom stærk nok til at fjerne et elektron helt fra det andet. I stedet deler de elektroner for at opnå en stabil elektronkonfiguration. Denne deling af elektroner er grundlaget for en kovalent binding.
I tilfælde af klor og brom danner de et diatomisk molekyle , CLBR, hvor hvert atom deler det ene elektron med den anden for at opnå en fuld ydre skal af elektroner.
Fortæl mig, hvis du gerne vil udforske mere om kovalent binding!
Sidste artikelHvad er den korrekte formel for sammensat dannet af Mg og S?
Næste artikelHvad er et kovalent oxid?
 Varme artikler
Varme artikler
-
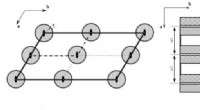 En ny klassificering af symmetrigrupper i krystalrummet foreslået af russiske videnskabsmændForbudt volumen i todimensionelle rumsymmetrigrupper:(venstre) p2 og (højre) pm. Bølget fyldning angiver forbudte områder. Kredit:Lobachevsky University Det indbyrdes arrangement af atomer i kryst
En ny klassificering af symmetrigrupper i krystalrummet foreslået af russiske videnskabsmændForbudt volumen i todimensionelle rumsymmetrigrupper:(venstre) p2 og (højre) pm. Bølget fyldning angiver forbudte områder. Kredit:Lobachevsky University Det indbyrdes arrangement af atomer i kryst -
 Smart kemi fjerner kræftbekæmpende lægemidler med alvorlige bivirkningerKredit:CC0 Public Domain Forskere fra Leiden University Medical Center (LUMC) og Leiden Institute of Chemistry har gjort en vigtig opdagelse om det almindeligt anvendte kræftbekæmpende stof doxoru
Smart kemi fjerner kræftbekæmpende lægemidler med alvorlige bivirkningerKredit:CC0 Public Domain Forskere fra Leiden University Medical Center (LUMC) og Leiden Institute of Chemistry har gjort en vigtig opdagelse om det almindeligt anvendte kræftbekæmpende stof doxoru -
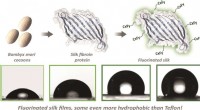 Forskere bruger modificerede silkeproteiner til at skabe nye nonstick-overfladerGrafisk abstrakt. Kredit:ChemBioChem (2022). DOI:10.1002/cbic.202200429 Forskere ved Tufts University har udviklet en metode til at lave silkebaserede materialer, der nægter at holde sig til vand,
Forskere bruger modificerede silkeproteiner til at skabe nye nonstick-overfladerGrafisk abstrakt. Kredit:ChemBioChem (2022). DOI:10.1002/cbic.202200429 Forskere ved Tufts University har udviklet en metode til at lave silkebaserede materialer, der nægter at holde sig til vand, -
 Sporing af bortskaffelse af proteiner kan føre til forbedrede behandlingerHiroaki Kiyokawa, MD, Ph.d., professor i farmakologi og patologi, var co-senior forfatter på undersøgelser publiceret i Naturkommunikation og Videnskabens fremskridt . Kredit:Northwestern Universi
Sporing af bortskaffelse af proteiner kan føre til forbedrede behandlingerHiroaki Kiyokawa, MD, Ph.d., professor i farmakologi og patologi, var co-senior forfatter på undersøgelser publiceret i Naturkommunikation og Videnskabens fremskridt . Kredit:Northwestern Universi
- Sådan fungerer elnet
- Hvordan et eksperimentelt 3D-printet kunstværk kunne hjælpe med at redde moderne kunst
- Hvordan hjalp den internationale rumstation udforskningen af rummet?
- Eksempler på ting, der afviser magneter?
- Undersøgelse finder, at mennesker står bag dyre, stigende risiko for naturbrande til millioner af …
- Når vand fryser ioniserer molekylerne?


