Svovl danner en ion af hvilken ladning?
Her er hvorfor:
* Svovls elektronkonfiguration: Svovl har 16 elektroner. Dens elektronkonfiguration er [NE] 3S² 3P⁴. Dette betyder, at det har 6 elektroner i sin yderste skal (Valence Shell).
* octet regel: Atomer har en tendens til at vinde eller miste elektroner for at opnå en stabil konfiguration med 8 elektroner i deres yderste skal (som ædelgasser).
* svovlens tendens: Svovl er to elektroner, der er mindre end en fuld ydre skal. For at opnå denne stabilitet får den to elektroner, hvilket resulterer i en -2 ladning.
Derfor er svovlion skrevet som s²⁻ .
Sidste artikelHvordan ekstraheres platin?
Næste artikelNavngiv to elementer, der har egenskaber, der ligner klor?
 Varme artikler
Varme artikler
-
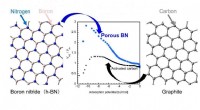 Fange gasser bedre med bornitrid-nanoporerSkematisk illustration af bornitrid- og kulstofstrukturer og adsorptionsevne på porøse bornitrid- og kulstofmaterialer. Kredit:2021 Takahiro Ohkubo Hvad er fælles mellem en teknologi til lagring a
Fange gasser bedre med bornitrid-nanoporerSkematisk illustration af bornitrid- og kulstofstrukturer og adsorptionsevne på porøse bornitrid- og kulstofmaterialer. Kredit:2021 Takahiro Ohkubo Hvad er fælles mellem en teknologi til lagring a -
 Biokemikere forbinder polyfenoler i ferskenblade med deres ekstrakts antioxidanteffektKredit:RUDN Universitet Biokemikere fra RUDN University har fastslået, hvilke stoffer i ferskenblade, der giver den antioxidante virkning af deres ekstrakt. De undersøgte sammensætningen af pulv
Biokemikere forbinder polyfenoler i ferskenblade med deres ekstrakts antioxidanteffektKredit:RUDN Universitet Biokemikere fra RUDN University har fastslået, hvilke stoffer i ferskenblade, der giver den antioxidante virkning af deres ekstrakt. De undersøgte sammensætningen af pulv -
 Brygget kaffegrums tilbyder et bæredygtigt alternativ til farvestof til tøjKredit:Iowa State University Forskere fra Iowa State University har fundet en naturlig måde at tilføje farve til tøjet ved at bruge resterne fra din daglige kop kaffe. Tekstilindustrien bruger me
Brygget kaffegrums tilbyder et bæredygtigt alternativ til farvestof til tøjKredit:Iowa State University Forskere fra Iowa State University har fundet en naturlig måde at tilføje farve til tøjet ved at bruge resterne fra din daglige kop kaffe. Tekstilindustrien bruger me -
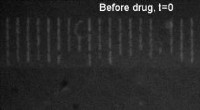 Ny teknik, hvor lægemidler får bakterier til at lyse, kan hjælpe med at bekæmpe antibiotikaresis…Lægemiddeloptagelse i bakterier før og efter. Kredit:Dr Stefano Pagliara, University of Exeter En ny teknik kan hjælpe med at reducere antibiotikaudskrivning ved at forudsige, hvilke lægemidler de
Ny teknik, hvor lægemidler får bakterier til at lyse, kan hjælpe med at bekæmpe antibiotikaresis…Lægemiddeloptagelse i bakterier før og efter. Kredit:Dr Stefano Pagliara, University of Exeter En ny teknik kan hjælpe med at reducere antibiotikaudskrivning ved at forudsige, hvilke lægemidler de
- Hvor meget energi bruger USA en dag?
- Friktion fungerer i en retning af, hvad man skal genstandsbevægelse?
- Fra havvand til ferskvand med et nanoteknologisk filter
- USA halter 79 andre nationer med at forhindre tilbageholdelse af børneindvandring
- Hvilke to kræfter handler på den varme luftballon?
- Har folk nogensinde været på månen?


