Hvorfor er det sværere at fjerne en indre skalelektron end en valens fra atom?
1. Elektrostatisk tiltrækning:
* indre skalelektroner er tættere på kernen: Jo tættere en elektron er på kernen, jo stærkere er den elektrostatiske attraktion mellem elektronet og de positivt ladede protoner i kernen.
* Valenselektroner er længere væk: Valenselektroner er i den yderste skal og oplever mindre tiltrækning fra kernen på grund af den større afstand og afskærmningseffekten af indre skalelektroner.
2. Afskærmningseffekt:
* indre skalelektroner afskærmer kernen: Indre skalelektroner fungerer som et "skjold" mellem kernen og valenselektroner. Denne afskærmning reducerer den effektive atomafgift, der opleves af valenselektroner, hvilket gør dem mindre tæt bundet.
3. Effektiv atomafgift:
* indre skalelektroner oplever en højere effektiv nuklearafgift: Den effektive atomafgift er den nettopositive ladning, der opleves af et elektron. Fordi indre skalelektroner er tættere på kernen og ikke afskærmet så meget, oplever de en større attraktion.
4. Kvantemekaniske effekter:
* indre skalelektroner er i lavere energiniveau: Elektroner i indre skaller optager lavere energiniveau, hvilket betyder, at de er mere stabile og kræver mere energi for at fjerne.
Kortfattet:
Kombinationen af stærkere elektrostatisk tiltrækning, afskærmningseffekter, højere effektiv nuklearafgift og lavere energiniveau gør det meget vanskeligere at fjerne et indre skalelektron sammenlignet med en valenselektron. Dette er grunden til, at ioniseringsenergier generelt øges, når du bevæger dig over en periode (på grund af stigende effektiv nuklearafgift) og falder, når du bevæger dig ned ad en gruppe (på grund af stigende afskærmning).
Sidste artikelHvor mange kloratomer ville være i en forbindelse med navnet tetrachlorid?
Næste artikelEr CaCl2 et metal eller ikke -metal?
 Varme artikler
Varme artikler
-
 Universelle latente aniondonorer til ultralave arbejdsfunktionsløsninger, der kan behandles elektro…KOH Qi-Mian holder løsningsprøver af huller (til venstre) og elektroninjektion (til højre), der er klar til løsning-behandling i omgivelserne til fremstilling af elektroder til halvlederanordninger. K
Universelle latente aniondonorer til ultralave arbejdsfunktionsløsninger, der kan behandles elektro…KOH Qi-Mian holder løsningsprøver af huller (til venstre) og elektroninjektion (til højre), der er klar til løsning-behandling i omgivelserne til fremstilling af elektroder til halvlederanordninger. K -
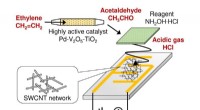 Udvikling af en lille sensor, der er i stand til løbende at overvåge phytohormon ethylenEn lille, meget følsom sensor, der er i stand til at detektere ethylen med stor selektivitet. Kredit:NIMS NIMS og AIST har udviklet en lille sensor, der er i stand til kontinuerligt at overvåge pl
Udvikling af en lille sensor, der er i stand til løbende at overvåge phytohormon ethylenEn lille, meget følsom sensor, der er i stand til at detektere ethylen med stor selektivitet. Kredit:NIMS NIMS og AIST har udviklet en lille sensor, der er i stand til kontinuerligt at overvåge pl -
 Team skaber bedre fingeraftryk for at opdage undvigende, værdifulde kemiske forbindelserBálint Sztáray, venstre, fra University of the Pacific, og Sandia National Laboratories kemiker David Osborn viser PEPICO-instrumentet. Kredit:Sandia National Laboratories Forestil dig at kunne se
Team skaber bedre fingeraftryk for at opdage undvigende, værdifulde kemiske forbindelserBálint Sztáray, venstre, fra University of the Pacific, og Sandia National Laboratories kemiker David Osborn viser PEPICO-instrumentet. Kredit:Sandia National Laboratories Forestil dig at kunne se -
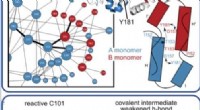 Forskere afslører, hvordan enzymbevægelser katalyserer reaktionerDenne illustration viser, hvordan et enzym bevæger sig og ændrer sig, når det katalyserer komplekse reaktioner og nedbryder organiske forbindelser. Kredit: Proceedings of the National Academy of Scien
Forskere afslører, hvordan enzymbevægelser katalyserer reaktionerDenne illustration viser, hvordan et enzym bevæger sig og ændrer sig, når det katalyserer komplekse reaktioner og nedbryder organiske forbindelser. Kredit: Proceedings of the National Academy of Scien
- En ny tilgang til at forbedre katalysatorerne for hydrogenudviklingsreaktion
- Er specifik varmekapacitet omvendt proportional med dens masse?
- Forskere går sammen for at vise, at skovens biodiversitet er grøn på mere end én måde
- Hvordan folk taler nu har spor om menneskelig migration for århundreder siden
- Hvad hedder burst af energi fra solen?
- Hvad er forskellen mellem en sø og en dam?


