Forskere afslører, hvordan enzymbevægelser katalyserer reaktioner
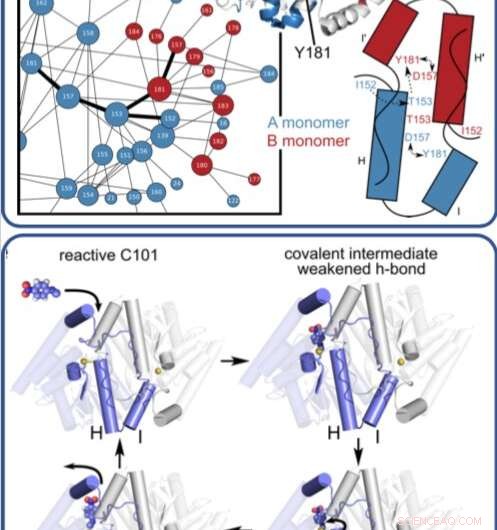
Denne illustration viser, hvordan et enzym bevæger sig og ændrer sig, når det katalyserer komplekse reaktioner og nedbryder organiske forbindelser. Kredit: Proceedings of the National Academy of Sciences
I et tidsløst røntgeneksperiment, forskere afslørede, ved atomopløsning og i realtid, den hidtil ukendte måde, at et mikrobielt enzym nedbryder organiske forbindelser.
Holdet, ledet af Mark Wilson ved University of Nebraska Lincoln (UNL) og Henry van den Bedem ved Department of Energy's SLAC National Accelerator Laboratory (nu hos Atomwise Inc.), offentliggjorde deres resultater i sidste uge i Proceedings of the National Academy of Sciences . Hvad de lærte om dette enzym, hvis struktur ligner en, der er impliceret i neurodegenerative sygdomme som Parkinsons, kunne føre til en bedre forståelse af, hvordan antibiotika nedbrydes af mikrober og til udvikling af mere effektive lægemidler.
Tidligere, forskerne brugte SLACs Stanford Synchrotron Radiation Lightsource (SSRL) til at opnå enzymets struktur ved meget lave temperaturer ved hjælp af røntgenkrystallografi. I dette studie, Medhanjali Dasgupta, en UNL kandidatstuderende, der var undersøgelsens første forfatter, brugt Linac Coherent Light Source (LCLS), SLAC's røntgenlaser, at se enzymet og dets substrat i krystallen bevæge sig og ændre sig, mens det gennemgik en fuld katalytisk cyklus ved stuetemperatur.
Forskerne brugte speciel software, designet af van den Bedem, der er meget følsomme over for at identificere proteinbevægelser fra røntgenkrystallografidata for at fortolke resultaterne, afsløre aldrig før sete bevægelser, der spiller en nøglerolle i at katalysere komplekse reaktioner, såsom nedbrydning af antibiotika. Næste, forskerne håber at kunne bruge LCLS til at opnå stuetemperaturstrukturer af andre enzymer for at få et bedre overblik over, hvordan bevægelserne i dem hjælper med at bevæge sig langs reaktioner.
 Varme artikler
Varme artikler
-
 Forskere finder ny form for hydrofobe molekyler i vandKredit:CC0 Public Domain Indlejringen af hydrofobe molekyler i vand ser helt anderledes ud end tidligere antaget. I vand, hydrofobe molekyler er omgivet af to forskellige vandpopulationer:den in
Forskere finder ny form for hydrofobe molekyler i vandKredit:CC0 Public Domain Indlejringen af hydrofobe molekyler i vand ser helt anderledes ud end tidligere antaget. I vand, hydrofobe molekyler er omgivet af to forskellige vandpopulationer:den in -
 Sådan fremstilles et vandfilter ved hjælp af sand og klipperMeget lidt af det vand, vi bruger hver dag, kommer helt ud af jorden. Nogle af urenhederne er mikroskopiske, men mange er store nok til at fjerne med et råfiltreringssystem, som du kan fremstille s
Sådan fremstilles et vandfilter ved hjælp af sand og klipperMeget lidt af det vand, vi bruger hver dag, kommer helt ud af jorden. Nogle af urenhederne er mikroskopiske, men mange er store nok til at fjerne med et råfiltreringssystem, som du kan fremstille s -
 Forbedret forståelse af industrielle elektrodeprocesserElektroden, der bruges til målingerne, er kun en hundrededel i tykkelsen af et menneskehår. Kredit:RUB, Marquard I den industrielle produktion af klor, specielle elektroder er for nylig blevet i
Forbedret forståelse af industrielle elektrodeprocesserElektroden, der bruges til målingerne, er kun en hundrededel i tykkelsen af et menneskehår. Kredit:RUB, Marquard I den industrielle produktion af klor, specielle elektroder er for nylig blevet i -
 Producerer egerhjul automatisk og fleksibelt af kompositmaterialerDr.-Ing. Marcel Bücker står foran det kørende produktionsanlæg, en roterende værktøjsplade. Kredit:Technische Universität Kaiserslautern Selv kalkmalerier i det gamle Egypten skildrer dem:egerhjul
Producerer egerhjul automatisk og fleksibelt af kompositmaterialerDr.-Ing. Marcel Bücker står foran det kørende produktionsanlæg, en roterende værktøjsplade. Kredit:Technische Universität Kaiserslautern Selv kalkmalerier i det gamle Egypten skildrer dem:egerhjul
- Hvordan transporterer en bregneplante vand og næringsstoffer?
- Sådan fungerer vand
- Palæogenomisk analyse kaster lys over Påskeøens mysterier
- Eleverne vil have undervisning i klimaforandringer. Skolerne er ikke klar
- Lysegrønne planter sparer nitrogen uden at ofre fotosynteseeffektiviteten
- Den kølende effekt af landbrugsvanding


